Таблица степеней окисления химических элементов. Возможные степени окисления химических элементов. Стандартные, высшие, низшие, редкие степени окисления, исключения. Максимальная степень окисления и минимальная степень окисления.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Степени окисления элементов — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.Степенью окисления — условный заряд атома в соединении, если считать, что связь в нём ионная.
Степень окисления равна числу электронов, смещённых от атома или к атому.
Если электроны смещаются от атома, то его степень окисления положительная. Положительная степень окисления у атома с меньшей электроотрицательностью.
Если смещение электронов происходит к атому, то его степень окисления отрицательная.
Обрати внимание!
В простых веществах сдвига электронов нет, и степень окисления атомов равна \(0\).
Значение степени окисления указывают над знаком химического элемента:
Ca+2O−2, N02.
Обрати внимание!
В сложных веществах степень окисления атомов металла всегда положительная.
Максимальное значение степени окисления металла можно определить по номеру группы, в которой элемент находится в Периодической таблице. Оно равно числу валентных электронов в атоме.
Металлы главных подгрупп в соединениях, как правило, проявляют постоянную степень окисления. У металлов \(IA\) группы она равна \(+1\):
Na+1Cl−1, Li+12O−2.
У металлов \(IIA\) группы степень окисления всегда равна \(+2\):
Mg+2F−12, Ba+2O−2.
Степень окисления алюминия — \(+3\):
Al+32S−23.
Металлы побочных подгрупп проявляют переменные степени окисления:
Fe+2O−2, Fe+32O−23.
Обрати внимание!
Атомы неметаллов имеют как положительные, так и отрицательные степени окисления.
У самого электроотрицательного из неметаллов фтора степень окисления постоянная и равна \(–1\):
H+1F−1, K+1F−1.
Кислород почти всегда имеет степень окисления \(–2\):
Na+12O−2, C+4O2−2.
Исключения — фторид кислорода и пероксиды:
O+2F−12, H+12O−12.
В большинстве соединений степень окисления водорода \(+1\), но в соединениях с металлами она равна \(–1\):
H+1Br−1, N−3H+13, Na+1H−1, Ca+2h3−1.
У атомов остальных неметаллов максимальное значение степени окисления тоже равно номеру группы:
C+4, N+5, S+6.
Минимальное значение степени окисления можно определить, если от номера группы отнять \(8\). Оно определяется числом электронов, которые необходимы атому до завершения внешнего электронного слоя:
C−4, N−3, S−2.
|
Порядковый номер |
Русское / англ. название |
Химический символ |
Степень окисления |
|
1 |
Водород / Hydrogen |
H |
(+1), (-1) |
|
2 |
Гелий / Helium |
He |
0 |
|
3 |
Литий / Lithium |
Li |
(+1) |
|
4 |
Бериллий / Beryllium |
Be |
(+2) |
|
5 |
Бор / Boron |
B |
(-1), 0, (+1), (+2), (+3) |
|
6 |
Углерод / Carbon |
C |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
|
7 |
Азот / Nitrogen |
N |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
|
8 |
Кислород / Oxygen |
O |
(-2), (-1), 0, (+1), (+2) |
|
9 |
Фтор / Fluorine |
F |
(-1) |
|
10 |
Неон / Neon |
Ne |
0 |
|
11 |
Натрий / Sodium |
Na |
(+1) |
|
12 |
Магний / Magnesium |
Mg |
(+2) |
|
13 |
Алюминий / Aluminum |
Al |
(+3) |
|
14 |
Кремний / Silicon |
Si |
(-4), 0, (+2), (+4) |
|
15 |
Фосфор / Phosphorus |
P |
(-3), 0, (+3), (+5) |
|
16 |
Сера / Sulfur |
S |
(-2), 0, (+4), (+6) |
|
17 |
Хлор / Chlorine |
Cl |
(-1), 0, (+1), (+3), (+5), (+7), редко (+2) и (+4) |
|
18 |
Аргон / Argon |
Ar |
0 |
|
19 |
Калий / Potassium |
K |
(+1) |
|
20 |
Кальций / Calcium |
Ca |
(+2) |
|
21 |
Скандий / Scandium |
Sc |
(+3) |
|
22 |
Титан / Titanium |
Ti |
(+2), (+3), (+4) |
|
23 |
Ванадий / Vanadium |
V |
(+2), (+3), (+4), (+5) |
|
24 |
Хром / Chromium |
Cr |
(+2), (+3), (+6) |
|
25 |
Марганец / Manganese |
Mn |
(+2), (+3), (+4), (+6), (+7) |
|
26 |
Железо / Iron |
Fe |
(+2), (+3), редко (+4) и (+6) |
|
27 |
Кобальт / Cobalt |
Co |
(+2), (+3), редко (+4) |
|
28 |
Никель / Nickel |
Ni |
(+2), редко (+1), (+3) и (+4) |
|
29 |
Медь / Copper |
Cu |
+1, +2, редко (+3) |
|
30 |
Цинк / Zinc |
Zn |
(+2) |
|
31 |
Галлий / Gallium |
Ga |
(+3), редко (+2) |
|
32 |
Германий / Germanium |
Ge |
(-4), (+2), (+4) |
|
33 |
Мышьяк / Arsenic |
As |
(-3), (+3), (+5), редко (+2) |
|
34 |
Селен / Selenium |
Se |
(-2), (+4), (+6), редко (+2) |
|
35 |
Бром / Bromine |
Br |
(-1), (+1), (+5), редко (+3), (+4) |
|
36 |
Криптон / Krypton |
Kr |
0 |
|
37 |
Рубидий / Rubidium |
Rb |
(+1) |
|
38 |
Стронций / Strontium |
Sr |
(+2) |
|
39 |
Иттрий / Yttrium |
Y |
(+3) |
|
40 |
Цирконий / Zirconium |
Zr |
(+4), редко (+2) и (+3) |
|
41 |
Ниобий / Niobium |
Nb |
(+3), (+5), редко (+2) и (+4) |
|
42 |
Молибден / Molybdenum |
Mo |
(+3), (+6), редко (+2), (+3) и (+5) |
|
43 |
Технеций / Technetium |
Tc |
(+6) |
|
44 |
Рутений / Ruthenium |
Ru |
(+3), (+4), (+8), редко (+2), (+6) и (+7) |
|
45 |
Родий / Rhodium |
Rh |
(+4), редко (+2), (+3) и (+6) |
|
46 |
Палладий / Palladium |
Pd |
(+2), (+4), редко (+6) |
|
47 |
Серебро / Silver |
Ag |
(+1), редко (+2) и (+3) |
|
48 |
Кадмий / Cadmium |
Cd |
(+2), редко (+1) |
|
49 |
Индий / Indium |
In |
(+3), редко (+1) и (+2) |
|
50 |
Олово / Tin |
Sn |
(+2), (+4) |
|
51 |
Сурьма / Antimony |
Sb |
(-3), (+3), (+5), редко (+4) |
|
52 |
Теллур / Tellurium |
Te |
(-2), (+4), (+6), редко (+2) |
|
53 |
Иод / Iodine |
I |
(-1), (+1), (+5), (+7), редко (+3), (+4) |
|
54 |
Ксенон / Xenon |
Xe |
0 |
|
55 |
Цезий / Cesium |
Cs |
(+1) |
|
56 |
Барий / Barium |
BA |
(+2) |
|
57 |
Лантан / Lanthanum |
La |
(+3) |
|
58 |
Церий / Cerium |
Ce |
(+3), (+4) |
|
59 |
Празеодим / Praseodymium |
Pr |
(+3) |
|
60 |
Неодим / Neodymium |
Nd |
(+3), (+4) |
|
61 |
Прометий / Promethium |
Pm |
(+3) |
|
62 |
Самарий / Samarium |
Sm |
(+3), редко (+2) |
|
63 |
Европий / Europium |
Eu |
(+3), редко (+2) |
|
64 |
Гадолиний / Gadolinium |
Gd |
(+3) |
|
65 |
Тербий / Terbium |
Tb |
(+3), (+4) |
|
66 |
Диспрозий / Dysprosium |
Dy |
(+3) |
|
67 |
Гольмий / Holmium |
Ho |
(+3) |
|
68 |
Эрбий / Erbium |
Er |
(+3) |
|
69 |
Тулий / Thulium |
Tm |
(+3), редко (+2) |
|
70 |
Иттербий / Ytterbium |
Ib |
(+3), редко (+2) |
|
71 |
Лютеций / Lutetium |
Lu |
(+3) |
|
72 |
Гафний / Hafnium |
Hf |
(+4) |
|
73 |
Тантал / Tantalum |
Ta |
(+5), редко (+3), (+4) |
|
74 |
Вольфрам / Tungsten |
W |
(+6), редко (+2), (+3), (+4) и (+5) |
|
75 |
Рений / Rhenium |
Re |
(+2), (+4), (+6), (+7), редко (-1), (+1), (+3), (+5) |
|
76 |
Осмий / Osmium |
Os |
(+3), (+4), (+6), (+8), редко (+2) |
|
77 |
Иридий / Iridium |
Ir |
(+3), (+4), (+6), редко (+1) и (+2) |
|
78 |
Платина / Platinum |
Pt |
(+2), (+4), (+6), редко (+1) и (+3) |
|
79 |
Золото / Gold |
Au |
(+1), (+3), редко (+2) |
|
80 |
Ртуть / Mercury |
Hg |
(+1), (+2) |
|
81 |
Талий / Thallium |
Tl |
(+1), (+3), редко (+2) |
|
82 |
Свинец / Lead |
Pb |
(+2), (+4) |
|
83 |
Висмут / Bismuth |
Bi |
(+3), редко (+3), (+2), (+4) и (+5) |
|
84 |
Полоний / Polonium |
Po |
(+2), (+4), редко (-2) и (+6) |
|
85 |
Астат / Astatine |
At |
— |
|
86 |
Радон / Radon |
Ra |
0 |
|
87 |
Франций / Francium |
Fr |
— |
|
88 |
Радий / Radium |
Ra |
(+2) |
|
89 |
Актиний / Actinium |
Ac |
(+3) |
|
90 |
Торий / Thorium |
Th |
(+4) |
|
91 |
Проактиний / Protactinium |
Pa |
(+5) |
|
92 |
Уран / Uranium |
U |
(+3), (+4), (+6), редко (+2) и (+5) |
Степень окисления элементов — Учебник по Химии.
 8 класс. Григорович
8 класс. ГригоровичУчебник по Химии. 8 класс. Григорович — Новая программа
Вспомните: определение электронной конфигурации атома (§ 13).
Понятие о степени окисления
Для характеристики химических реакций часто возникает необходимость указать число электронов, которые принимают участие в том или ином процессе. Если для веществ с ионной связью для этого достаточно знать заряды образованных ионов, то в веществах с ковалентной связью определить заряды довольно сложно. Поэтому для всех соединений, независимо от типа их химической связи, используют более универсальное понятие — степень окисления.
Степень окисления определяется числом отданных или принятых электронов в веществах с ионной связью и числом электронов в составе общих электронных пар, образующих ковалентную полярную связь.
Степень окисления — это условный заряд на атоме в молекуле (кристалле), определенный с предположением, что все общие электронные пары полностью смещены в сторону более электроотрицательного элемента.
В простейших ионных соединениях степень окисления совпадает с зарядами ионов, например:
Это правило распространяется на все основные оксиды: степень окисления металлического элемента равна заряду иона металлического элемента (Натрия — +1, Бария — +2, Алюминия — +3), а степень окисления Оксигена равна -2.
Рассматривая соединения с ковалентной полярной связью, принимают, что общая электронная пара полностью переходит к более электроотрицательному элементу. В этом случае в гидроген флуориде и воде степени окисления будут следующие:
Возможные степени окисления элементов
Степени окисления, которые элементы могут проявлять в разных соединениях, в большинстве случаев можно определить по строению внешнего электронного уровня или по положению элемента в Периодической системе.
Атомы металлических элементов могут только отдавать электроны, поэтому в соединениях они проявляют положительные степени окисления. Максимальное значение — высшая степень окисления — обычно равно числу электронов на внешнем уровне, а следовательно, и номеру группы в Периодической системе.
Максимальное значение — высшая степень окисления — обычно равно числу электронов на внешнем уровне, а следовательно, и номеру группы в Периодической системе.
Атомы неметаллических элементов могут проявлять как положительную, так и отрицательную степень окисления. Максимальная положительная степень окисления — высшая степень окисления, как и для металлических элементов, равна числу валентных электронов. А низшая степень окисления определяется тем, сколько электронов не хватает атому, чтобы на внешнем уровне их было восемь (табл. 7).
Кроме высшей и низшей степени окисления многие элементы могут также проявлять и промежуточные степени окисления. Определить их для s- и p-элементов можно по таблице 7.
Таблица 7. Наиболее характерные степени окисления s- и р-элементов
Група ПС | I | II | III | IV | V | VI | VII |
Высшая степень окисления | +1 | +2 | +3 | +4 | +5 | +6 (кроме О) | +7 (кроме F) |
Промежуточные степени окисления | — | — | — | +2, 0 | +3, 0 | +4, +2, 0 | +5, +3, +1, 0 |
Низшая степень окисления | 0 | 0 | 0 | -4 | -3 | -2 | -1 |
Некоторые химические элементы не подчиняются этим правилам. Среди них Гидроген, Оксиген, Флуор:
Среди них Гидроген, Оксиген, Флуор:
Определение степеней окисления в бинарных соединениях
Для определения степеней окисления в соединениях недостаточно знать возможные степени окисления элементов. Для этого следует пользоваться определенными правилами. Прежде всего, принципом электронейтральности: поскольку любое вещество является электронейтральным, то сумма степеней окисления атомов всех элементов, из которых состоит вещество, должно быть равным нулю.
Для определения степеней окисления элементов в бинарных соединениях можно воспользоваться следующим алгоритмом:
Алгоритм определения степени окисления элементов в бинарных соединениях (на примере фосфор(V) сульфида и кальций фосфида)
Выводы
1. Степень окисления определяет число принятых или отданных электронов. Для одноатомных ионов степень окисления равна заряду иона. В других случаях она равна заряду на атоме в молекуле или кристалле, вычисленному с допущением, что все общие электронные пары полностью смещены в сторону более электроотрицательного элемента.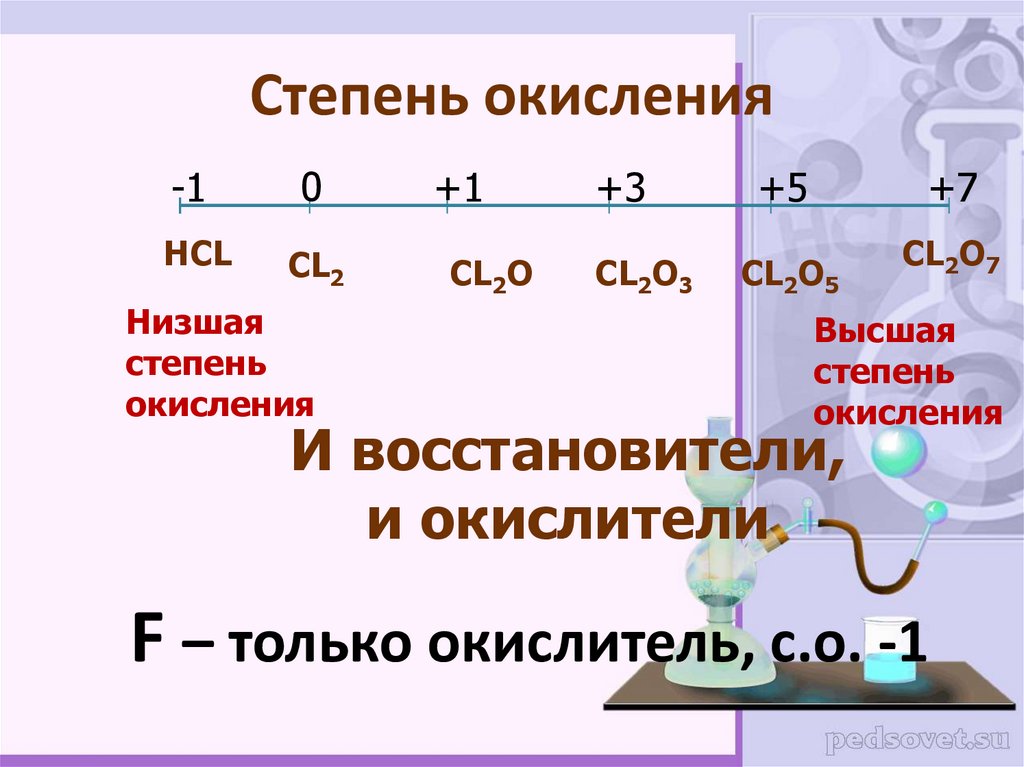
2. При определении степени окисления необходимо помнить, что сумма степеней окисления всех атомов в соединении равна нулю. У атомов более электроотрицательного элемента в соединении степень окисления отрицательная, а у других элементов — положительная.
Контрольные вопросы
1. Дайте определение понятию «степень окисления».
2. В чем заключается сходство и различие понятий «степень окисления» и «валентность»?
3. Как можно определить высшую, низшую и промежуточные степени окисления элементов по Периодической системе?
4. Чему равна низшая степень окисления металлических элементов?
5. Сформулируйте алгоритм определения степеней окисления элементов в бинарных соединениях.
6. Какова степень окисления элементов в простых веществах? Почему она именно такая?
Задания для усвоения материала
1. Определите валентность и степень окисления всех элементов по следующим структурным формулам:
2. По положению элементов в Периодической системе определите возможные валентности и степени окисления: а) Калия; б) Магния; в) Брома; г) Фосфора; д) Сульфура.
По положению элементов в Периодической системе определите возможные валентности и степени окисления: а) Калия; б) Магния; в) Брома; г) Фосфора; д) Сульфура.
3. Определите степени окисления элементов в соединениях с Гидрогеном: СН4, NH3, H2S, HCl, СаН2.
4. Определите степени окисления элементов в веществах:
а) AlF3, BaCl2, CaS, К3Р, SnO2;
б) l2, N2O3, PbCl4, Cl2O7, SbCl3;
в) ClF3, NaF, Р4, FeI2, MgS;
г) CF4, Са, CS2, Аl4С3, РСl5;
д) FeS, IBr, TeCl4, SF6, NF3;
е) CS2, ХеO4, ССl4, РСl5, Мn2O7.
5. Приведите формулы веществ, в которых степени окисления Гидрогена и Карбона равны их валентностям.
Степень окисления — ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА — ОБЩАЯ ХИМИЯ — Химия подготовка к ЗНО и ДПА
ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
Степень окисления
Степень окисления — это условный заряд на атоме в молекуле или кристалле, который возник на нем, когда бы все полярные связи, созданные им, имели ионный характер.
На
отличие от валентности, степени окисления может быть положительным, отрицательным или
равняться нулю. В простых ионных соединениях степень окисления совпадает с
зарядами ионов. Например, в натрий хлориде NaCl (Na+Cl—) Натрий имеет степень окисления +1, а Хлор
-1, в кальций оксиде СаО (Са+2О-2) Кальций проявляет
степень окисления +2, а Оксисен — -2. Это правило распространяется на все основные
оксиды: степень окисления металлического элемента равен заряду иона металла
(Натрия +1, Бария +2, Алюминия +3), а степень окисления Кислорода равна-2.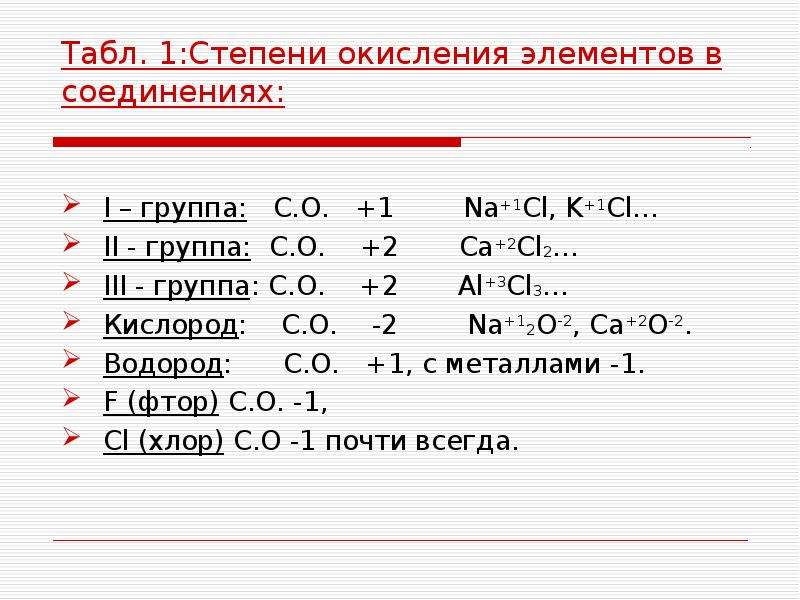 Степень окисления обозначают арабскими цифрами, которые ставят над символом
элемента, подобно валентности, причем вначале указывают знак заряда, а
потом его численное значение:
Степень окисления обозначают арабскими цифрами, которые ставят над символом
элемента, подобно валентности, причем вначале указывают знак заряда, а
потом его численное значение:
Если модуль степени окисления равна единице, то число «1» можно не ставить и писать только знак: Na+Cl—.
Степень окисления и валентность — родственные понятия. Во многих соединениях абсолютная величина степени окисления элементов совпадает с их валентностью. Однако существует немало случаев, когда валентность отличается от степени окисления.
В простых веществах — неметалах существует ковалентная неполярная связь, совместная электронная пара смещается к одному из атомов, поэтому степень окисления элементов в простых веществ всегда равна нулю. Но атомы друг с другом связаны, то есть проявляют определенную валентность, как, например, в кислороде валентность Кислорода равна II, а в азоте валентность Азота — III:
В молекуле водород пероксида валентность Кислорода также равна II, а Водорода — И:
Н-О-О-Н.
Но степень окисления Кислорода в этом соединении равна-1.
Хотя степень окисления и валентность — разные понятия, иногда их употребляют одно вместо другое. Так, если говорят о том, что валентность Натрия в натрий хлориде равен И, то имеют в виду степень окисления Натрия равна +1. В вообще металлические элементы редко образуют ковалентные связи, поэтому под валентностью металлических элементов в соединениях имеют в виду их степень окисления. Например, называя вещество феррум(III) оксидом, имеют в виду, что Ферум в этом соединении проявляет степень окисления +3.
Определение возможных степеней окисления элементов
Степени окисление, какие элементы могут проявлять в различных соединениях, в большинстве случаев можно определить по строению внешнего электронного уровня или по местом элемента в Периодической системе.
Атомы
металлических элементов могут только отдавать электроны, поэтому в соединениях они
проявляют положительные степени окисления. Его абсолютное значение во многих
случаях (за исключением d-элементов)
равен числу электронов на внешнем уровне, то есть номера группы в
Периодической системе. Атомы d-элементов
могут также отдавать электроны с передзовнішнього уровня, а именно — с
незаполненных d-орбиталей. Поэтому
для d-элементов определить все возможные
степени окисления значительно сложнее, чем для s- и р-элементов. С уверенностью можно
утверждать, что большинство d-элементов
проявляют степень окисления +2 благодаря электронам внешнего электронного
уровня, а максимальная степень окисления в большинстве случаев равен номеру
группы.
Его абсолютное значение во многих
случаях (за исключением d-элементов)
равен числу электронов на внешнем уровне, то есть номера группы в
Периодической системе. Атомы d-элементов
могут также отдавать электроны с передзовнішнього уровня, а именно — с
незаполненных d-орбиталей. Поэтому
для d-элементов определить все возможные
степени окисления значительно сложнее, чем для s- и р-элементов. С уверенностью можно
утверждать, что большинство d-элементов
проявляют степень окисления +2 благодаря электронам внешнего электронного
уровня, а максимальная степень окисления в большинстве случаев равен номеру
группы.
Атомы неметаллических элементов могут проявлять как положительные, так и отрицательные степени окисление, в зависимости от того, с атомом какого элемента они образуют связь. Если элемент более электроотрицательным, то он проявляет негативное степень окисления, а если менее электроотрицательный — положительный.
Абсолютное
значение степени окисления неметаллических элементов можно определить по строению
внешнего электронного слоя. Атом способен принять столько электронов, чтобы на
его внешнем уровне расположилось восемь электронов: неметаллические элементы VII
группы принимают один электрон и проявляют степень окисления -1, VI группы — два электроны и проявляют
степень окисления -2 и т.д.
Атом способен принять столько электронов, чтобы на
его внешнем уровне расположилось восемь электронов: неметаллические элементы VII
группы принимают один электрон и проявляют степень окисления -1, VI группы — два электроны и проявляют
степень окисления -2 и т.д.
Неметаллические элементы способны отдавать разное число электронов: максимум столько, сколько расположено на внешнем энергетическом уровне. Иначе говоря, максимальный степень окисления неметаллических элементов равна номеру группы. Благодаря промотуванню электронов на внешнем уровне атомов число неспаренных электронов, которые атом может отдавать в химических реакциях, бывает разным, поэтому неметаллические элементы способны обнаруживать различные промежуточные значения степени окисления.
Возможны степени окисления s- и р-элементов
|
Группа ПС |
1 |
II |
III |
IV |
V |
VI |
VII |
|
Высшую степень окисления |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
|
Промежуточный степень окисления |
|
|
|
+2, 0 |
+3, 0 |
+4, +2, 0 |
+5, +3, +1, 0 |
|
Ниже степень окисления |
0 |
0 |
0 |
-4 |
-3 |
-2 |
-1 |
Определение степеней окисления в соединениях
Любая
электронейтральная молекула, поэтому сумма степеней окисления атомов всех элементов
должна равняться нулю. Определим степень окисления в сульфур(ИV) оксиде SO2 тауфосфор(V)
сульфіді P2S5.
Определим степень окисления в сульфур(ИV) оксиде SO2 тауфосфор(V)
сульфіді P2S5.
Сульфур(ИV) оксид SO2 образован атомами двух элементов. Из них электроотрицательности большая у Кислорода, поэтому атомы Кислорода будут иметь негативный степень окисления. Для Кислорода он равен-2. В этом случае Сульфур оказывает положительное степень окисления. В различных соединениях Сульфур может проявлять разные степени окисления, поэтому в этом случае его необходимо вычислить. В молекуле SO2 два атома Кислорода со степенью окисления -2, поэтому общий заряд атомов Кислорода равна-4. Для того, чтобы молекула была електронейтральною, атом Серы имеет полностью нейтрализовать заряд обоих атомов Кислорода, поэтому степень окисления Серы равна +4:
В
молекуле фосфор(V)
сульфида P2S5 более електронегативним элементом является
Сульфур, то есть он проявляет негативное степень окисления, а Фосфор — положительный. Для Серы негативный степень окисления составляет только 2. Вместе пять
атомов Серы несут отрицательный заряд, равный-10. Поэтому два атома
Фосфора имеют нейтрализовать этот заряд с общим зарядом +10. Поскольку атомов
Фосфора в молекуле два, то каждый должен иметь степень окисления +5:
Для Серы негативный степень окисления составляет только 2. Вместе пять
атомов Серы несут отрицательный заряд, равный-10. Поэтому два атома
Фосфора имеют нейтрализовать этот заряд с общим зарядом +10. Поскольку атомов
Фосфора в молекуле два, то каждый должен иметь степень окисления +5:
Сложнее вычислять степень окисления не в бинарных соединениях — солях, основаниях и кислотах. Но для этого также следует воспользоваться принципом электронейтральности, а еще помнить о том, что в большинстве соединений степень окисления Кислорода составляет -2, Водорода +1.
Рассмотрим это на примере калий сульфата K2SO4. Степень окисления Калия в соединениях может быть только +1, а Кислорода -2:
С принципа электронейтральности вычисляем степень окисления Серы:
2 (+1) + 1 (х) + 4 (-2) = 0, откуда х = +6.
При определении степеней окисления элементов в соединениях следует придерживаться таких правил:
1. Степень
окисления элемента в простом веществе равна нулю.
Степень
окисления элемента в простом веществе равна нулю.
2. Фтора — наиболее электроотрицательный химический элемент, поэтому степень окисления Фтора в всех соединениях равна-1.
3. Оксиген — наиболее электроотрицательный элемент после Фтора, поэтому степень окисления Кислорода во всех соединениях, кроме фторидов, отрицательный: в большинстве случаев он равна -2, а в пероксидах — -1.
4. Степень окисления Водорода в большинстве соединений равна +1, а в соединениях с металлическими элементами (гидридах) — -1.
5. Степень окисления металлов в соединениях всегда положительный.
6. Более электроотрицательный элемент всегда имеет отрицательный степень окисления.
7. Сумма степеней окисления всех атомов в молекуле равна нулю.
Химия подготовка к ЗНО и ДПАКомплексное издание ЧАСТЬ И ОБЩАЯ ХИМИЯ ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА Степень окисления Степень
окисления — это условный заряд на атоме в молекуле или кристалле, который возник на
нем, когда бы все полярные связи, созданные им, имели ионный характер. На отличие от валентности, степени окисления может быть положительным, отрицательным или равняться нулю. В простых ионных соединениях степень окисления совпадает с зарядами ионов. Например, в натрий хлориде NaCl (Na + Cl — ) Натрий имеет степень окисления +1, а Хлор -1, в кальций оксиде СаО (Са +2 О -2) Кальций проявляет степень окисления +2, а Оксисен — -2. Это правило распространяется на все основные оксиды: степень окисления металлического элемента равен заряду иона металла (Натрия +1, Бария +2, Алюминия +3), а степень окисления Кислорода равна-2. Степень окисления обозначают арабскими цифрами, которые ставят над символом элемента, подобно валентности, причем вначале указывают знак заряда, а потом его численное значение:Если модуль степени окисления равна единице, то число «1» можно не ставить и писать только знак: Na + Cl — .Степень
окисления и валентность — родственные понятия. Во многих соединениях абсолютная величина
степени окисления элементов совпадает с их валентностью. В простых веществах — неметалах существует ковалентная неполярная связь, совместная электронная пара смещается к одному из атомов, поэтому степень окисления элементов в простых веществ всегда равна нулю. Но атомы друг с другом связаны, то есть проявляют определенную валентность, как, например, в кислороде валентность Кислорода равна II, а в азоте валентность Азота — III: В молекуле водород пероксида валентность Кислорода также равна II, а Водорода — И: Определение возможных степеней окисления элементов Степени окисление, какие элементы могут проявлять в различных соединениях, в большинстве случаев можно определить по строению внешнего электронного уровня или по местом элемента в Периодической системе. Атомы
металлических элементов могут только отдавать электроны, поэтому в соединениях они
проявляют положительные степени окисления. Его абсолютное значение во многих
случаях (за исключением
d
-элементов)
равен числу электронов на внешнем уровне, то есть номера группы в
Периодической системе. Атомы неметаллических элементов могут проявлять как положительные, так и отрицательные степени окисление, в зависимости от того, с атомом какого элемента они образуют связь. Если элемент более электроотрицательным, то он проявляет негативное степень окисления, а если менее электроотрицательный — положительный. Абсолютное
значение степени окисления неметаллических элементов можно определить по строению
внешнего электронного слоя. Атом способен принять столько электронов, чтобы на
его внешнем уровне расположилось восемь электронов: неметаллические элементы VII
группы принимают один электрон и проявляют степень окисления -1, VIгруппы — два электроны и проявляют
степень окисления -2 и т. Неметаллические элементы способны отдавать разное число электронов: максимум столько, сколько расположено на внешнем энергетическом уровне. Иначе говоря, максимальный степень окисления неметаллических элементов равна номеру группы. Благодаря промотуванню электронов на внешнем уровне атомов число неспаренных электронов, которые атом может отдавать в химических реакциях, бывает разным, поэтому неметаллические элементы способны обнаруживать различные промежуточные значения степени окисления. Возможны степени окисления s — и р-элементов
Определение степеней окисления в соединениях Любая
электронейтральная молекула, поэтому сумма степеней окисления атомов всех элементов
должна равняться нулю. Сульфур(И V ) оксид SO 2 образован атомами двух элементов. Из них электроотрицательности большая у Кислорода, поэтому атомы Кислорода будут иметь негативный степень окисления. Для Кислорода он равен-2. В этом случае Сульфур оказывает положительное степень окисления. В различных соединениях Сульфур может проявлять разные степени окисления, поэтому в этом случае его необходимо вычислить. В молекуле SO 2 два атома Кислорода со степенью окисления -2, поэтому общий заряд атомов Кислорода равна-4. Для того, чтобы молекула была електронейтральною, атом Серы имеет полностью нейтрализовать заряд обоих атомов Кислорода, поэтому степень окисления Серы равна +4: В
молекуле фосфор( V
)
сульфида
P
2
S
5
более електронегативним элементом является
Сульфур, то есть он проявляет негативное степень окисления, а Фосфор — положительный.
Для Серы негативный степень окисления составляет только 2. Сложнее вычислять степень окисления не в бинарных соединениях — солях, основаниях и кислотах. Но для этого также следует воспользоваться принципом электронейтральности, а еще помнить о том, что в большинстве соединений степень окисления Кислорода составляет -2, Водорода +1. Рассмотрим это на примере калий сульфата K 2 SO 4 . Степень окисления Калия в соединениях может быть только +1, а Кислорода -2: С принципа электронейтральности вычисляем степень окисления Серы: 2(+1) + 1 (х) + 4 (-2) = 0, откуда х = +6. При определении степеней окисления элементов в соединениях следует придерживаться таких правил: 1. Степень окисления элемента в простом веществе равна нулю. 2. Фтора
— наиболее электроотрицательный химический элемент, поэтому степень окисления Фтора в
всех соединениях равна-1. 3. Оксиген — наиболее электроотрицательный элемент после Фтора, поэтому степень окисления Кислорода во всех соединениях, кроме фторидов, отрицательный: в большинстве случаев он равна -2, а в пероксидах — -1. 4. Степень окисления Водорода в большинстве соединений равна +1, а в соединениях с металлическими элементами (гидридах) — -1. 5. Степень окисления металлов в соединениях всегда положительный. 6. Более электроотрицательный элемент всегда имеет отрицательный степень окисления. 7. Сумма степеней окисления всех атомов в молекуле равна нулю. |
Элемент | Характерная степень окисления | Исключения |
Гидриды металлов: LIH -1 | ||
Степенью окисления называют условный заряд частицы в предположении, что связь полностью разорвана (имеет ионных характер). H — Cl = H + + Cl — , Связь в соляной кислоте ковалентная полярная. Электронная пара в большей степени смещена в сторону атома Cl — , т.к. он более электроотрицацельный элемент. Как определить степень окисления?Электроотрицательность — это способность атомов притягивать к себе электроны других элементов. Степень окисления указывается над элементом: Br 2 0 , Na 0 , O +2 F 2 -1 , K + Cl — и т.д. Она может быть отрицательной и положительной. Степень окисления простого вещества (несвязанное, свободное состояние) равна нулю. Степень окисления кислорода у большинстве соединений равна -2 (исключение составляют пероксиды Н 2 О 2 , где она равна -1 и соединения с фтором — O +2 F 2 -1 , O 2 +1 F 2 -1 ). — Степень окисления простого одноатомного иона равна его заряду: Na + , Ca +2 . Водород в своих соединениях имеет степень окисления равную +1 (исключения составляют гидриды — Na + H — и соединения типа C +4 H 4 -1 ). В связях «металл-неметалл» отрицательную степень окисления имеет тот атом, который обладает большей электрооприцательностью (данные об элеткроотрицательности приведены в шкале Полинга): H + F — , Cu + Br — , Ca +2 (NO 3 ) — и т.д. Правила определения степени окисления в химических соединениях.Возьмем соединение KMnO 4 , необходимо определить степень окисления у атома марганца. Рассуждения:
К + Mn X O 4 -2 Пусть Х — неизвестная нам степень окисления марганца. Количество атомов калия — 1, марганца — 1, кислорода — 4. Доказано, что молекула в целом электронейтральна, поэтому ее общий заряд должен быть равен нулю. 1*(+1) + 1*(X ) + 4(-2) = 0, Х = +7, Значит, степень окисления марганца в перманганате калия = +7. Возьмем другой пример оксида Fe 2 O 3 . Необходимо определить степень окисления атома железа. Рассуждение:
2*(Х) + 3*(-2) = 0, Вывод: степень окисления железа в данном оксиде равна +3. Примеры. Определить степени окисления всех атомов в молекуле. 1. K 2 Cr 2 O 7 . Степень окисления К +1 , кислорода О -2 . Учитывая индексы: О=(-2)×7=(-14), К=(+1)×2=(+2). Т.к. алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, то число положительных степеней окисления равно числу отрицательных. Степени окисления К+О=(-14)+(+2)=(-12). Из этого следует, что у атома хрома число положительных степеней равно 12, но атомов в молекуле 2, значит на один атом приходится (+12):2=(+6). Ответ: К 2 + Cr 2 +6 O 7 -2 . 2. (AsO 4) 3- . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е. — 3. Составим уравнение: х+4×(— 2)= — 3 . Ответ: (As +5 O 4 -2) 3- . |
Как определить степень окисления? Таблица Менделеева позволяет записывать данную количественную величину для любого химического элемента.
Определение
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.
Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
У металлов второй группы (подгруппы А) +2 степень окисления.
Таблица позволяет определить данную величину не только у элементов, проявляющих металлические свойства, но и у неметаллов. Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Для примера возьмем оксид кальция СаО. Для кальция, расположенного в главной подгруппе второй группы, величина будет являться постоянной, равной +2. У кислорода, имеющего неметаллические свойства, данный показатель будет являться отрицательной величиной, и он соответствует -2. Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.
Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять разные значения. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
У неметалла, располагающегося в конце бинарной формулы, степень окисления имеет отрицательное значение. Так как этот элемент располагается в шестой группе, при вычитании из восьми шести получаем, что степень окисления у кислорода соответствует -2. Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента.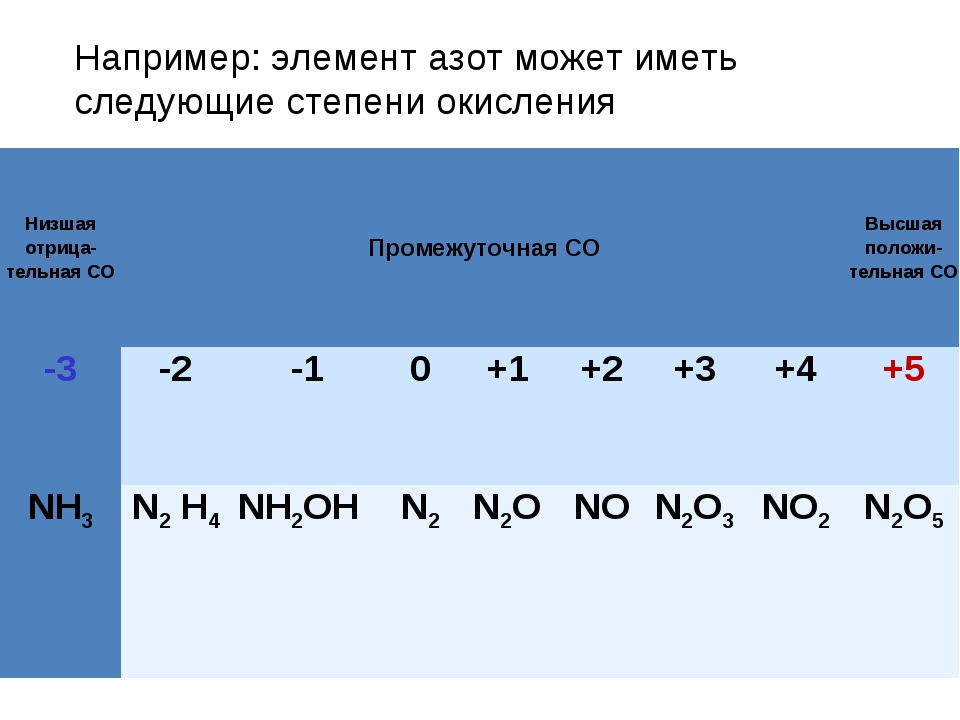 Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.
Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.
Пример определения в серной кислоте
Формула данного соединения имеет вид H 2 SO 4 . У водорода степень окисления составит +1, у кислорода она равна -2. Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.
Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
Для характеристики состояния элементов в соединениях введено понятие степени окисления. Под степенью окисления понимается условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов. Степень окисления обозначается арабской цифрой, которую ставят перед символом элемента, со знаком «+» или «−», соответствующим отдаче или приобретению электронов. Степень окисления представляет собой всего лишь удобную форму для учета переноса электронов, ее не следует рассматривать ни как эффективный заряд атома в молекуле (например, в молекуле LiF эффективные заряды Li и F равны соответственно +0,89 и −0,89, тогда как степени окисления +1 и −1), ни как валентность элемента (например в соединениях CH 4 , CH 3 OH, HCOOH, CO 2 валентность углерода равна 4, а степени окисления соответственно равны −4, −2, +2, +4).
Численные значения валентности и степени окисления могут совпадать по абсолютной величине лишь при образовании соединений с ионной связью. При определении степени окисления используют следующие правила:
При определении степени окисления используют следующие правила:
1. Атомы элементов, находящихся в свободном состоянии или в виде молекул простых веществ, имеют степень окисления, равную нулю, например Fe, Cu, H 2 , N 2 и т.п.
2. Степень окисления элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду данного иона, например,
3. Водород в большинстве соединений имеет степень окисления +1, за исключением гидридов металлов (NaH, LiH), в которых степень окисления водорода равна −1.
Наиболее распространенная степень окисления кислорода в соединениях –2, за исключением пероксидов (Na 2 O 2 , Н 2 О 2 – степень окисления кислорода равна −1) и F 2 O (степень окисления кислорода равна +2).
Для элементов с непостоянной степенью окисления ее значение можно рассчитать, зная формулу соединения и учитывая, что сумма степеней окисления всех атомов в молекуле равна нулю. В сложном ионе эта сумма равна заряду иона. Например, степень окисления атома хлора в молекуле HClO 4 , вычисленная исходя из суммарного заряда молекулы = 0, х – степень окисления атома хлора), равна +7. Степень окисления атома серы в ионе SO равна +6.
Степень окисления атома серы в ионе SO равна +6.
Окислительно-восстановительные свойства элемента зависят от степени его окисления. У атомов одного и того же элемента различают низшую , высшую и промежуточные степени окисления .
Зная степень окисления элемента в соединении, можно предсказать, окислительные или восстановительные свойства это соединение проявляет.
В качестве примера рассмотрим серу S и ее соединения H 2 S, SO 2 и SO 3 . Связь между электронной структурой атома серы и его окислительно-восстановительными свойствами в этих соединениях наглядно представлена в таблице 7.1.
Видеокурс «Получи пятерку» включает все темы, необходимые для успешной сдачи ЕГЭ по математике на 60-65 баллов. Полностью все задачи 1-13 Профильного ЕГЭ по математике. Подходит также для сдачи Базового ЕГЭ по математике. Если вы хотите сдать ЕГЭ на 90-100 баллов, вам надо решать часть 1 за 30 минут и без ошибок!
Курс подготовки к ЕГЭ для 10-11 класса, а также для преподавателей. Все необходимое, чтобы решить часть 1 ЕГЭ по математике (первые 12 задач) и задачу 13 (тригонометрия). А это более 70 баллов на ЕГЭ, и без них не обойтись ни стобалльнику, ни гуманитарию.
Все необходимое, чтобы решить часть 1 ЕГЭ по математике (первые 12 задач) и задачу 13 (тригонометрия). А это более 70 баллов на ЕГЭ, и без них не обойтись ни стобалльнику, ни гуманитарию.
Вся необходимая теория. Быстрые способы решения, ловушки и секреты ЕГЭ. Разобраны все актуальные задания части 1 из Банка заданий ФИПИ. Курс полностью соответствует требованиям ЕГЭ-2018.
Курс содержит 5 больших тем, по 2,5 часа каждая. Каждая тема дается с нуля, просто и понятно.
Сотни заданий ЕГЭ. Текстовые задачи и теория вероятностей. Простые и легко запоминаемые алгоритмы решения задач. Геометрия. Теория, справочный материал, разбор всех типов заданий ЕГЭ. Стереометрия. Хитрые приемы решения, полезные шпаргалки, развитие пространственного воображения. Тригонометрия с нуля — до задачи 13. Понимание вместо зубрежки. Наглядное объяснение сложных понятий. Алгебра. Корни, степени и логарифмы, функция и производная. База для решения сложных задач 2 части ЕГЭ.
Валентность и степень окисления.
 элементов
В большинстве случаев степень окисления равна валентности и отличается от нее только знаком. Но встречаются соединения, в которых степень окисления элемента не равна его валентности. Как уже указывалось, в простых веществах степень окисления элемента всегда равна нулю независимо от его валентности. В табл. 8 сопоставлены валентности и степени окисления некоторых элементов- в различных соединениях. [c.89]
элементов
В большинстве случаев степень окисления равна валентности и отличается от нее только знаком. Но встречаются соединения, в которых степень окисления элемента не равна его валентности. Как уже указывалось, в простых веществах степень окисления элемента всегда равна нулю независимо от его валентности. В табл. 8 сопоставлены валентности и степени окисления некоторых элементов- в различных соединениях. [c.89]
Глава 3. Валентность, степень окисления, заряд иона. Области применимости этих понятий. Предсказание возможных значений валентности и степени окисления химического элемента на основе его положения в Периодической системе [c.71]
Изменение химических свойств элементов в группах имеет ряд интересных закономерностей. Номер группы соответствует наибольшей степени окисления элементов (см. 5.4). Д. И. Менделеев характеризовал значение высшей валентности элементов на основании их соединений с кислородом. Значение валентности по кислороду по группам возрастает от 1 до 8. Значение валентности по водороду имеет максимум для IV группы. В сумме обе валентности, начиная с IV группы, дают 8 (например, СОа и СН4, UO, и НС1). Номер группы, таким образом, указывает число электронов атомов элементов, которые могут участвовать в образовании химических связей, определяет диапазон валентных возможностей атомов элементов. В этом физический смысл номера группы в периодической системе. [c.90]
Значение валентности по кислороду по группам возрастает от 1 до 8. Значение валентности по водороду имеет максимум для IV группы. В сумме обе валентности, начиная с IV группы, дают 8 (например, СОа и СН4, UO, и НС1). Номер группы, таким образом, указывает число электронов атомов элементов, которые могут участвовать в образовании химических связей, определяет диапазон валентных возможностей атомов элементов. В этом физический смысл номера группы в периодической системе. [c.90]
Некоторые свойства, такие, как ионизационный потенциал, сродство к электрону, электроотрицательность, валентность (степень окисления), а также атомный и ионный радиусы, позволяют предсказать и объяснить химические свойства элементов, также закономерно изменяющиеся с ростом порядкового номера и периодически повторяющиеся у элементов одной группы. [c.107]
Элементы в соединениях металлы водород кислород Степень окисления = Валентность Степень окисления = + 1 Степень окисления = -2 +2 -2 Си О +1 -2 н,о [c. 59]
59]
Названия соединений, содержащих металл и неметалл, состоят из названия неметалла (элемента с большей электроотрицательностью), образованного добавлением к латинской основе окончания -ид названия металла (элемента с меньшей электроотрицательностью) валентности (степени окисления) металла, которая указывается римской цифрой в круглых скобках. [c.138]
Охарактеризуйте валентность и степень окисления элементов подгруппы цинка [c.170]
Первоначально к комплексным (координационным) соединениям относили только те соединения, в которых была превышена стехиометрическая валентность (степень окисления элемента) центрального атома. По этим представлениям комплекс состоит из центрального атома А, окруженного непосредственно связанными с ним отдельными атомами (или ионами) В и электронейтральными группами (молекулами) С остальные (не связанные непосредственно с А) ионы образуют внешнюю сферу комплексного соединения. Атомы (или ионы) В и группы С называются лигандами, а их суммарное число — координационным числом центрального атома А. Координационное число всегда больше числа, определяющего стехиометрическую валентность (степень окисления элемента) атома А. [c.33]
Координационное число всегда больше числа, определяющего стехиометрическую валентность (степень окисления элемента) атома А. [c.33]
Восстановление — химическая реакция, противоположная окислению. При В. атом или ионы присоединяют электроны. При этом происходит понижение валентности (степени окисления) элемента. Примеры В. оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ В. органических кислот в альдегиды и спирты гидрогенизация жиров и др. [c.34]
Мыслимы и реакции диспропорционирования, в которых при изменении степени окисления элемента его валентность остается постоянной. К ним относятся многие процессы с участием органических соединений, например реакции [c.92]
Применение понятия степень окисления элемента , как и численное выражение валентности, возможно лишь в известных пределах и нельзя придавать этому понятию однозначный физический смысл. [c.85]
[c.85]
Известны и другие соединения нулевой степени окисления -элементов, например Сг(РРз)в, Мо(РРз)в, Сг(РРз)з(СО)з, Ре(М0)4, Ре(N0),(С0) К1[Р(С,Н5)з14. В этих соединениях молекулы-лиганды выступают в качестве а-доноров и я-акцепторов электронных пар. Координационные числа -элементов здесь также обусловливаются числом свободных орбиталей, возникающих при спаривании валентных электронов комплексообразователя. [c.463]
К настоящему времени определены атомные массы всех открытых элементов, дана классификация различных веществ. Развитие атомно-молекулярного учения привело к возникновению и широкому использованию в химии других важных понятий. К ним относятся валентность, степень окисления, координационное число, электроотрицательность и др. Современное понимание их в значительной мере основывается на результатах развития теории строения атомов и молекул. Поэтому эти и другие понятия атомно-молекулярного учения будут даны после изложения соответствующих тем. [c.27]
[c.27]
В ряде других случаев получаются соединения определенной валентности, однако они очень легко окисляются кислородом воздуха. Чтобы избежать этого, колбу, в которую собирают раствор после восстановления, наполняют углекислым газом. Иногда раствор, вытекающий из редуктора, собирают в коническую колбу, содержащую 10—15 мл 20%-ного раствора железных квасцов. Восстановленный до низшей степени окисления элемент тотчас реагирует с ионами трехвалентного лелеза, например [c.370]
Составьте энергетические диаграммы распределения электронов атомов 1) углерода, 2) азота, 3) кислорода, 4) серы, 5) хлора, 6) брома, 7) йода. Предскажите возможные валентные состояния (или степени окисления) элементов. Выделите те состояния, при которых отвечающие им соединения могут играть роли восстановителя, окислителя, а также окислителя и восстацовителя одновременно. [c.266]
Записать рядом знаки химических элементов (или формулы ионов), образующих соединение. Проставить над ними известные (из правил или из условия) значения валентности (степени окисления, заряда иона). [c.82]
Проставить над ними известные (из правил или из условия) значения валентности (степени окисления, заряда иона). [c.82]
Элементы углерод С, кремний Si, германий Ge, олово Sn и свинец РЬ составляют IVA группу Периодической системы Д. И, Менделеева. Общая электронная формула валентного уровня атомов этих элементов ns np . Преобладающие степени окисления элементов в соединениях ( + 11) и ( + 1V), По электроотрицательности элементы С и Si относят к неметаллам. Ge, Sn и РЬ — к амфотерным элементам с возрастающим металлическим характером по мере увеличения порядкового номера. Поэтому в соединениях элементов со степенью окисления (IV) связи ковалентны для свинца (И) и в меньшей степени для олова (И) известны ионные кристаллы. В целом устойчивость степени окисления ( + IV) уменьшается, а устойчивость степени окисления ( + 11) увеличивается от С к РЬ. Соединения свинца (IV) —сильные окислители, соединения остальных элементов в степени окисления (И) — сильные восстановители. [c.202]
[c.202]
Кластеры типичны для соединений -элементов, металлы которых имеют высокие энергии атомизации. В кластерных соединениях с формально низкими степенями окисления -элементов валентные электроны их атомов в значительной степени используются на связи М—М, а оставшиеся образуют связи с атомами неметаллов (партнерами). В итоге все валентные электроны атомов -элементов в кластерах принимают участие в образовании связей независимо от степени окисления. [c.109]
Соединение Элемент Валентность Степень окисления [c.88]
Понятие степени окисления, таким образом, пришло на смену понятию электровалентности. В связи с этим представляется нецелесообразным пользоваться и понятием ковалентности. Для характеристики элементов лучше применять понятие валентности, определяя ее чис-лом электронов, используемых данным атомом для образования электронных пар, независимо от того, притягиваются они к данному атому или, наоборот, оттягиваются от него. Тогда валентность будет выражаться числом без знака. В отличие от валентности степень окисления определяется числом электронов, оттянутых от данного атома, — положительная, или притянутых к нему, — отрицательная. Во многих случаях арифметические значения валентности и степени окисления [c.16]
Тогда валентность будет выражаться числом без знака. В отличие от валентности степень окисления определяется числом электронов, оттянутых от данного атома, — положительная, или притянутых к нему, — отрицательная. Во многих случаях арифметические значения валентности и степени окисления [c.16]
Мы уже установили ранее (см. 2—4, гл. III), что понятие положительной и отрицательной валентности — так называемой степени окисления — чаще всего носит условный, формальный характер. Тем не менее использование этого понятия оказывается весьма полезным при рассмотрении окислительно-восстановительных процессов. Дело в том, что в молекуле любого вещества сумма степеней окисления элементов, составляющих молекулу, равна нулю, поэтому, зная степени окисления некоторых элементов, можно учесть изменения в валентном состоянии и других элементов в молекула. [c.188]
Упражнения, предложенные в данной главе, рекомендуется выполнять в процессе изучения периодического закона, строения атомов, теории химической связи, валентности и степени окисления элементов. [c.43]
[c.43]
При образовании соединений с ковалентной связью часто нужно ставить также знак валентности. Хотя определение знака валентности в таких случаях сугубо условное, оно очень удобно при подборе коэффициентов в уравнениях окислительно-восстановительных реакций. В соединениях с ковалентной связью определяют не валентность, а степень окисления, которая является более общим понятием, чем электровалентность. Так, в молекулах HjO, Oj, N. ионов нет, поэтому здесь можно говорить не об электровалентности, а о степени окисления элементов. [c.18]
Для большинства неорганических кристаллических веществ характерно полимерное строение Молекулярные решетки встречаются чрезвычайно редко, что было установлено уже в первых рентгеноструктурных исследованиях. Тогда же было показано, что координационное число элементов кристаллической решетки, как правило, больше числа его обычной валентности (степени окисления), что позволяет рассматривать неорганические полимерные соединения как комплексные. Комплексные составляющие таких неорганических полимеров можно условно выделить на основании анализа кристаллической структуры. [c.671]
Комплексные составляющие таких неорганических полимеров можно условно выделить на основании анализа кристаллической структуры. [c.671]
Какова валентность и степень окисления элементов в молекулах свободных галогенов [c.170]
Высшая положительная степень окисления проявляется, когда в образовании связи принимают участие все валентные электроны атома. Численно она равна номеру группы периодической системы и является важной количественной характеристикой элемента в его соединениях. Наименьшее значение степени окисления элемента, которое встречается в его соединениях, принято называть низшей степенью окисления. Все остальные степени окисления элемента называют промежуточными. Например, у атома (элемента) серы высшая степень окисления равна +6, низшая [c.57]
Номер группы связан с валентностью находящихся в ней элементов. Как правило, высшая положительная валентность (степень окисления) элементов равна номеру группы. Исключением являются фтор — он бывает только отрицательно одновалентным, бром — не бывает семивалентным медь, серебро, золото могут проявлять валентность +1, +2 и +3 из элементов VUI группы валентность +8 известна только для осмия и рутения (рутений открыт русским химиком К- К. Клаусом в 1844 г. и назван в честь России, латинское Ruthenia — Россия). [c.187]
Клаусом в 1844 г. и назван в честь России, латинское Ruthenia — Россия). [c.187]
Качественный и количеспвенпый состав вещества изображают с помощью химической формулы, составляемой иа основании валентностей (степеней окисления) элементов, образующих данное вещество. Валентностью называют число, показывающее, со сколькими одновалентными атомами соединен (или замещает их) атом данного элемента. За единицу валентности принята валентность атома водорода, который считается одновалентным, Таким образом, валентность элемента в соединении с водородом определяется число , атомов водорода, присоединяемых одним атомом данного элемента. [c.26]
Степень окисления элемента очень часто не совпадает с его валентностью, которая, как известно, определяется числом электронов, принимающих участие в перекрывании электронных облаков и образовании общего электронного облака связи. Так, в молекулах Н2 и H I каждый из атомов отдает по одному электрону на образование o6niero электронного облака связи. Степени же окислсния их различны. В молекуле Н2 максимальная плотность облака связи сосредоточена на равном расстоянии от ядер обоих атомов, поскольку оба они равноценны. Поэтому атомы сохраняют свой электронейтральный характер и степень окисления их равна нулю. В молекуле же H I максимальная плотьгость электронного облака р есколько смещена к хлору, поэтому степень окисления хлора равна — 1, а водорода + 1. [c.141]
Степени же окислсния их различны. В молекуле Н2 максимальная плотность облака связи сосредоточена на равном расстоянии от ядер обоих атомов, поскольку оба они равноценны. Поэтому атомы сохраняют свой электронейтральный характер и степень окисления их равна нулю. В молекуле же H I максимальная плотьгость электронного облака р есколько смещена к хлору, поэтому степень окисления хлора равна — 1, а водорода + 1. [c.141]
Как известно, таблица Менделеева подразделяется на семь горизонтальных периодов и восемь вертикальных групп. Первый период включает всего два элемента, второй и третий периоды — по восемь, четвертый и пятый — по восемнадцатй, шестой и седьмой — по тридцать два элемента. Первые три периода называются малыми, а четвертый и следующие — большими последние в таблице Менделеева подразделяются на ряды, малые же периоды совпадают с соответствующими рядами. В каждой группе элементы больших периодов подразделяются на две подгруппы — главную и побочную. Элементы малых — второго и третьего периодов в каждой группе относятся к главной подгруппе. Основанием для помещения элементов в ту или иную группу являлась максимально возможная валентность (вернее, степень окисления) элемента — последней соответствует номер группы исключение составляют кислород, фтор, неон и элементы побочной подгруппы VUI группы, валентность которых никогда не достигает соответственно [c.23]
Основанием для помещения элементов в ту или иную группу являлась максимально возможная валентность (вернее, степень окисления) элемента — последней соответствует номер группы исключение составляют кислород, фтор, неон и элементы побочной подгруппы VUI группы, валентность которых никогда не достигает соответственно [c.23]
V группа, главная подгрупп а азот, фосфор, мышьяк, сурьма, висмут. Атомы этих элементов имеют на внешнем уровне по пять электронов из которых неспарены только три р-электрона. Такому состоянию соответствует степень окисления элементов —3, например в гидридах ЭНд. При возбуждении атомов происходит разъединение -электронов и один из них переходит на -подуровень (за исключением атомов азота, не имеющих внешних -подуровней). Валентных электронов становится пять, они находятся в состоянии 5 -возбуждения, которому соответствует степень окисления элементов в соединениях +5. [c.232]
Изобразите геометрическую конфигурацию молекулы пероксида водо[)од 1. Почему молекула Н2О2 полярна Составьте электронную формулу Н2О2, укажите степени окисления элементов и валентность атома кислорода. [c.99]
Почему молекула Н2О2 полярна Составьте электронную формулу Н2О2, укажите степени окисления элементов и валентность атома кислорода. [c.99]
Особенности строения электронных оболочек атомов элементов IV группы обусловливают способность их проявлять переменную валентность (степень окисления). Но если углерод и кремний образуют главным образом соединения, где они четырехвалентны, то для германия, олова и свинца в равной мере возможны и двух- и четырехвалентное состояния, причем устойчивость двухвалентного состояния повышается от германия к свинцу. Это объясняется тем, что у меньших по объему атомов углерода и кремния (и в какой-то мере германия) легко осуществляется 5р -гибридизация, вследствие чего образуется четыре равноценные ковалентные связи. С ростом радиуса атомов склонность орбиталей к гибридизации уменьшается, а удаление неспареиных электронов с р-орбиталей олова и свинца осуществляется легче, чем спаренных электронов с 5-орбиталей. [c.184]
Элементы цинк 2п, кадмий Сс1 и ртуть Нд составляют ПБ группу Периодической системы Д. И. Менделеева. Валентный электронный уровень их атомов имеет формулу пз , поскольку (/г—I) /-подуровень полностью заполняется, приобретает повышенную устойчивость и валентным уже не является. Поэтому свойства цинка, кадмия и (в меньшей степени) ртути имеют сходство и со свойствами 5р-элементов, и тех /-элементов, у атомов которых (п—I) -подуровень заполнен лишь ча-стично. Характерная степень окисления элементов ПБ группы равна ( + 11), для ртутн характерна и степень окисления ( + ) [c.228]
И. Менделеева. Валентный электронный уровень их атомов имеет формулу пз , поскольку (/г—I) /-подуровень полностью заполняется, приобретает повышенную устойчивость и валентным уже не является. Поэтому свойства цинка, кадмия и (в меньшей степени) ртути имеют сходство и со свойствами 5р-элементов, и тех /-элементов, у атомов которых (п—I) -подуровень заполнен лишь ча-стично. Характерная степень окисления элементов ПБ группы равна ( + 11), для ртутн характерна и степень окисления ( + ) [c.228]
В двухэлементных веществах с молекулярным или ионным строением абсолютные значения зарядов ионов отвечают стехиометрической валентности атомов, например, для Na20 — Na и О», для P I3 — Р» и С1. Одновременно знак и значение зарядов ионов отвечают соответствующим (положительным или отрицательным) степеням окисления элементов, например [c.15]
Изобразите электронные формулы следующих молекул С12, 1л2, Рг, НР, Н О, РНз, СН4, Н2О2. Укажите полярные и неполярные связи. Определите валентность атомов и степень окисления элементов. [c.53]
Определите валентность атомов и степень окисления элементов. [c.53]
Элементы Б-групп (побочных подгрупп) Периодической системы ( / -элементы). Особенности электронного строения атомов, общая электронная конфигурация. Валентные электроны и степени окисления. Высшие степени окисления элементов ПБ-УПБ-групп, особенности у элементов 1Б- и У1ПБ-групп. [c.182]
Вещества, в которых значения степеней окисления элементов совпадают с проявляемыми ими валентностями (Nh4, НгО,-SO3, Ag I и т. п.), называют соединениями первого порядка (или простыми соединениями), а вещества, в которых элементы проявляют дополнительные валентности, рассматривают как соединения высшего порядка и называют комплексными. [c.106]
Все оксиды переходных металлов при обычной температуре твердые вещества, кроме МП2О7 (жидкость). Состав оксидов в низших степенях окисления элемента, как правило, не подчиняется правилам обычной валентности. Это фазы переменного состава, например НОо. за — Т101,2 НЬО д — КЬОг.г Рео.вэО-Рео.эзО. Их электронейтральность поддерживается изменением [c.499]
за — Т101,2 НЬО д — КЬОг.г Рео.вэО-Рео.эзО. Их электронейтральность поддерживается изменением [c.499]
Степени окисления (степени окисления)
Использование степеней окисления для определения того, что было окислено, а что восстановлено
Это наиболее распространенное использование степеней окисления.
Помните:
Окисление включает повышение степени окисления
Восстановление включает уменьшение степени окисления
В каждом из следующих примеров мы должны решить, включает ли реакция окислительно-восстановительный процесс, и если да, то что было окислено, а что восстановлено.
Пример 1:
Это реакция между магнием и соляной кислотой или газообразным хлористым водородом:
Mg + 2HCl MgCl 2 + H 2
Изменились ли степени окисления чего-либо? Да, они есть — у вас есть два элемента, которые находятся в соединениях с одной стороны уравнения и в виде несвязанных элементов с другой. Проверьте все степени окисления, чтобы быть уверенным:.
Проверьте все степени окисления, чтобы быть уверенным:.
Степень окисления магния увеличилась — он окислился.Степень окисления водорода упала — он восстановился. Хлор находится в одинаковой степени окисления в обеих частях уравнения — он не окисляется и не восстанавливается.
Пример 2:
Реакция между гидроксидом натрия и соляной кислотой:
NaOH + HCl NaCl + H 2 O
Проверка всех степеней окисления:
Ничего не изменилось. Это не окислительно-восстановительная реакция.
Пример 3:
Это подлый! Реакция между хлором и холодным разбавленным раствором гидроксида натрия:
2NaOH + Cl 2 NaCl + NaClO + H 2 O
Очевидно, хлор изменил степень окисления, потому что он оказался в соединениях, начиная с исходного элемента. Проверка всех степеней окисления показывает:
Хлор — это единственная вещь, которая изменила степень окисления. Он окислился или восстановился? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала. Второй окислился.
Он окислился или восстановился? Да! Оба! Один атом был восстановлен, потому что его степень окисления упала. Второй окислился.
Это хороший пример реакции диспропорционирования . Реакция диспропорционирования – это реакция, при которой одно вещество одновременно окисляется и восстанавливается.
Использование степеней окисления для определения окислителя и восстановителя
Это небольшое дополнение к последнему разделу.Если вы знаете, что окислялось, а что восстанавливалось, то вы можете легко определить, что такое окислитель и восстановитель.
Пример 1
Это реакция между ионами хрома (III) и металлическим цинком:
2Cr 3+ + Zn 2Cr 2+ + Zn 2+
Хром перешел из степени окисления +3 в +2 и, таким образом, был восстановлен. Цинк перешел от нулевой степени окисления в элементе к +2.Он был окислен.
Так что же делает сокращение? Это цинк — цинк отдает электроны ионам хрома (III). Таким образом, цинк является восстановителем.
Точно так же вы можете решить, что окислителем должны быть ионы хрома (III), потому что они забирают электроны у цинка.
Пример 2
Это уравнение реакции между ионами манганата(VII) и ионами железа(II) в кислой среде. Это проработано ниже на странице.
MNO 4 4 — + 8H + + 5FE 2+ MN 2+ + 4H 2 O + 5FE 3+
При быстром рассмотрении видно, что ионы железа(II) окислились до ионов железа(III). Каждый из них потерял электрон, а их степень окисления увеличилась с +2 до +3.
Водород все еще находится в степени окисления +1 до и после реакции, но ионы манганата (VII) явно изменились.Если посчитать степень окисления марганца, то она упала с +7 до +2 — восстановление.
Итак, ионы железа(II) окислились, а ионы манганата(VII) восстановились.
Что восстановило ионы манганата(VII) — однозначно это ионы железа(II). Железо — единственное, что имеет измененную степень окисления. Таким образом, ионы железа (II) являются восстановителем.
Аналогично, ионы манганата(VII) должны быть окислителями.
Использование степеней окисления для расчета пропорций реакции
Это иногда бывает полезно, когда вам нужно определить реакционные пропорции для использования в реакциях титрования, когда у вас недостаточно информации для расчета полного ионного уравнения.
Помните, что каждый раз, когда степень окисления изменяется на одну единицу, передается один электрон. Если степень окисления одного вещества в реакции падает на 2, это означает, что оно приобрело 2 электрона.
Что-то еще в реакции должно терять эти электроны. Любое понижение степени окисления одного вещества должно сопровождаться таким же повышением степени окисления чем-то другим.
Этот пример основан на информации из старого вопроса уровня AQA A’.
Ионы, содержащие церий в степени окисления +4, являются окислителями. (Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2- ). В процессе церий восстанавливается до степени окисления +3 (Ce 3+ ). Каковы пропорции реакции?
Степень окисления молибдена увеличивается на 4. Это означает, что степень окисления церия должна упасть на 4, чтобы компенсировать это.
Но степень окисления церия в каждом из его ионов падает только с +4 до +3 — падение на 1. Таким образом, очевидно, что на каждый ион молибдена должно приходиться 4 иона церия.
Реагирующие пропорции: 4 церийсодержащих иона на 1 ион молибдена.
Или взять более распространенный пример с участием ионов железа (II) и ионов манганата (VII). . .
Раствор манганата калия(VII), KMnO 4 , подкисленный разбавленной серной кислотой, окисляет ионы железа(II) до ионов железа(III). При этом ионы манганата(VII) восстанавливаются до ионов марганца(II). Используя степени окисления, составьте уравнение реакции.
При этом ионы манганата(VII) восстанавливаются до ионов марганца(II). Используя степени окисления, составьте уравнение реакции.
Степень окисления марганца в манганат-ионе (VII) равна +7. Название говорит вам об этом, но попробуйте еще раз, просто для практики!
При переходе к ионам марганца (II) степень окисления марганца упала на 5. Каждый реагирующий ион железа (II) увеличивает свою степень окисления на 1. Это означает, что должно быть пять ионов железа (II), реагирующих на каждый ион манганата(VII).
Таким образом, левая часть уравнения будет:
MnO 4 — + 5Fe 2+ + ?
Правая часть будет:
Mn 2+ + 5Fe 3+ + ?
После этого вам придется гадать, как сбалансировать оставшиеся атомы и заряды. В этом случае, например, вполне вероятно, что кислород окажется в воде. Это означает, что вам нужно откуда-то взять водород.
Это не проблема, потому что у вас есть реакция в растворе кислоты, так что водород вполне может происходить из ионов водорода.
В конце концов, вы получите это:
MNO 4 4 — + 8H + + 5FE 2+ MN 2+ + 4H 2 O + 5FE 3+
Лично я предпочел бы вычислять эти уравнения из электронных полууравнений!
числа окисления
числа окисленияНомера окисления
Часто полезно следить за химическими реакциями, наблюдая за изменениями в окислении числа атомов в каждом соединении во время реакции.Окислительные числа также играют важную роль. важную роль в систематической номенклатуре химических соединений. По определению окисление Число атома — это заряд, который атом имел бы, если бы соединение состояло из ионы.
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы. только одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 ,
и металлический алюминий имеют степень окисления 0.
только одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 ,
и металлический алюминий имеют степень окисления 0.
2. Степень окисления простых ионов равна заряду иона. Окисление число натрия в ионе Na + равно +1, например, а степень окисления хлор в ионе Cl — равен -1.
3. Степень окисления водорода +1, когда он соединяется с неметаллом как в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он соединяется с металлом как в.LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы группы IA образуют соединения (такие как Li 3 N и Na 2 S) в котором атом металла имеет степень окисления +1.
6. Элементы группы IIA образуют соединения (такие как Mg 3 N 2 и
CaCO 3 ), в котором атом металла имеет степень окисления +2.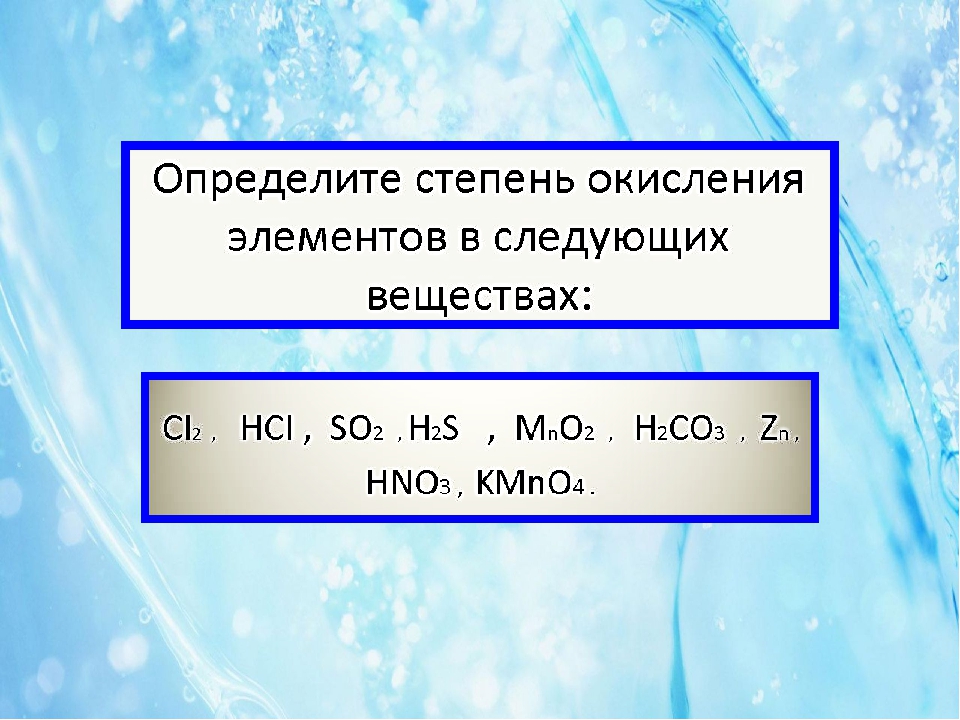
7. Кислород обычно имеет степень окисления -2.Исключение составляют молекулы и многоатомные ионы, содержащие связи O-O, такие как O 2 , O 3 , H 2 O 2 , и ион O 2 2-.
8. Элементы группы VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ), в котором неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
Н 2 О: 2(+1) + (-2) = 0
10.Сумма степеней окисления многоатомного иона равна заряду атома. ион. Степень окисления атома серы в ионе SO 4 2- должна быть +6, например, потому что сумма степеней окисления атомов в этом ионе должна равно -2.
SO 4 2- : (+6) + 4(-2) = -2
11. Элементы в нижнем левом углу периодической таблицы.
с большей вероятностью имеют положительные степени окисления, чем те, которые расположены в правом верхнем углу
угол стола. Сера имеет положительную степень окисления в SO 2 , для
Например, потому что он ниже кислорода в периодической таблице.
Сера имеет положительную степень окисления в SO 2 , для
Например, потому что он ниже кислорода в периодической таблице.
ТАК 2 : (+4) + 2(-2) = 0
Степень окисления — MCAT Физический
Если вы считаете, что контент, доступный с помощью Веб-сайта (как это определено в наших Условиях обслуживания), нарушает одно
или более ваших авторских прав, пожалуйста, сообщите нам, предоставив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному агенту, указанному ниже.Если университетские наставники примут меры в ответ на
ан
Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент
средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей контент, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно искажать информацию о том, что продукт или деятельность нарушают ваши авторские права.Таким образом, если вы не уверены, что содержимое находится на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Чтобы подать уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от его имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, как вы утверждаете, нарушает ваши авторские права, в \
достаточно подробно, чтобы преподаватели университета могли найти и точно идентифицировать этот контент; например, мы требуем
а
ссылку на конкретный вопрос (а не только название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
Отправьте жалобу нашему назначенному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Расчет степени окисления углерода – Master Organic Chemistry
Формализм состояния окисления
К концу Gen Chem расчет степени окисления различных металлов должен быть довольно знакомым.
Вот что вы делаете. Возьмем, к примеру, типичное соединение — FeCl 3 . Рассматривайте каждую связь между металлом и другим атомом, как если бы это была ионная связь. Это означает, что более электроотрицательные элементы (например, хлор или кислород) несут отрицательный заряд, а менее электроотрицательный элемент (например, металл) несет положительный заряд.
Если соединение является нейтральным, сумма степеней окисления также должна быть нейтральной. (Если соединение имеет заряд, вы соответственно корректируете степени окисления, чтобы их сумма равнялась заряду).
1. Расчет степеней окисления в неорганических соединениях
А теперь забавное упражнение. Попробуйте применить те же правила к углероду.
Это будет немного странно. Почему? Потому что есть два принципиальных отличия.
- Во-первых, , углерод часто более электроотрицательный (2,5), чем некоторые из атомов, с которыми он связан (например, H, 2,2).
 Так что же делать в этом случае?
Так что же делать в этом случае? - Во-вторых, в отличие от связей металл-металл, связи углерод-углерод распространены повсеместно.Итак, как вы справляетесь с ними?
Два ответа.
- В связи C-H H рассматривается так, как если бы он имел степень окисления +1. Это означает, что каждая связь CH будет уменьшать степень окисления углерода на 1.
- Любые две связи между одним и тем же атомом не влияют на степень окисления (напомним, что степень окисления Cl в Cl-Cl (и H в HH ) равен нулю. Таким образом, углерод, присоединенный к 4 атомам углерода, имеет нулевую степень окисления. 4 ) до +4 (например, в CO 2 ).Вот несколько примеров.
2. Расчет степени окисления углерода
(Не забывайте, что это называется «формализмом» по какой-то причине. Заряд углерода на самом деле не +4 или –4. Но формализм степени окисления помогает нам отслеживать, куда уходят электроны, что очень скоро пригодится).

Поняв, как рассчитать степени окисления углерода, мы готовы к следующему шагу: пониманию изменений в степени окисления углерода посредством реакций, известных как окисления (при которых степень окисления увеличивается), и сокращений (где степень окисления снижена).-, Fe4[Fe(CN)6]3, Nh5NO3, so42-, ch4cooh, cuso4*5h3o).
Степень окисления атома – это заряд этого атома после ионного приближения его гетероядерных связей. Степень окисления является синонимом степени окисления. Определить степень окисления по структуре Льюиса (рис. 1а) даже проще, чем вывести ее из молекулярной формулы (рис. 1б). Степень окисления каждого атома можно рассчитать, вычитая сумму неподеленных пар и электронов, которые он получает от связей, из числа валентных электронов.Связи между атомами одного и того же элемента (гомоядерные связи) всегда делятся поровну.
Рисунок 1. Различные способы отображения степеней окисления этанола и уксусной кислоты.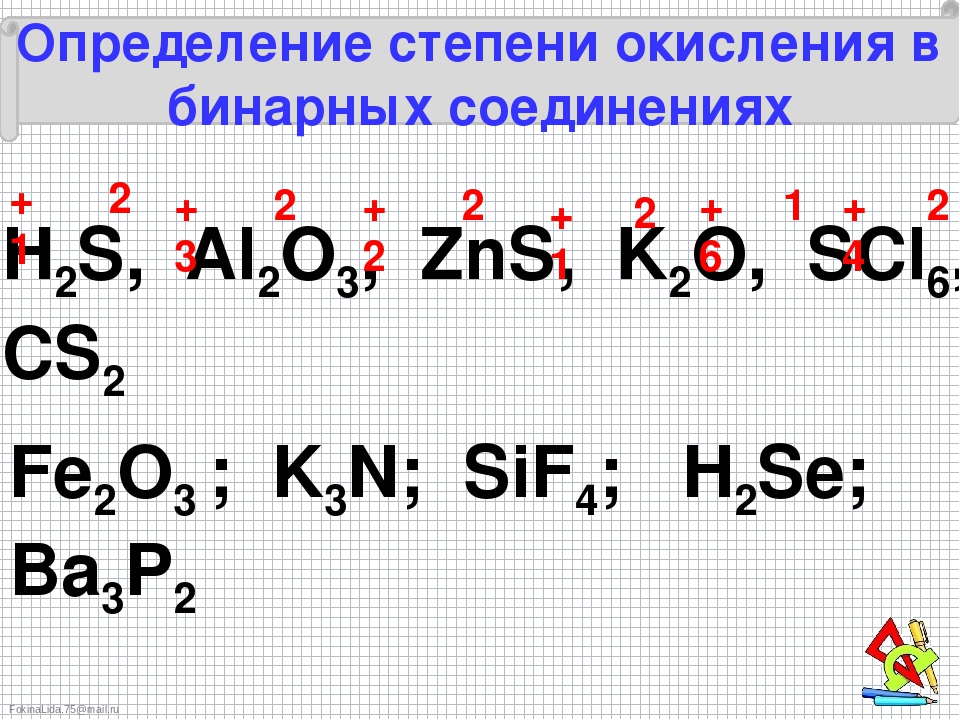 R является аббревиатурой для любой группы, в которой атом углерода присоединен к остальной части молекулы связью C-C. Обратите внимание, что замена группы CH 3 на R не меняет степени окисления центрального атома. → Загрузить изображение высокого качества
R является аббревиатурой для любой группы, в которой атом углерода присоединен к остальной части молекулы связью C-C. Обратите внимание, что замена группы CH 3 на R не меняет степени окисления центрального атома. → Загрузить изображение высокого качестваПри работе с органическими соединениями и формулами с несколькими атомами одного и того же элемента проще работать с молекулярными формулами и средними степенями окисления (рис. 1d).Органические соединения могут быть записаны таким образом, что все, что не изменяется до первой связи С-С, заменяется аббревиатурой R (рис. 1с). В отличие от радикалов в органических молекулах, R не может быть водородом. Поскольку электроны между двумя атомами углерода распределены равномерно, группа R не изменяет степени окисления атома углерода, к которому она присоединена. Вы можете найти примеры использования на странице Разделите окислительно-восстановительную реакцию на две полуреакции.
Правила присвоения степеней окисления
- Степень окисления свободного элемента всегда равна 0.

- Степень окисления одноатомного иона равна заряду иона.
- Фтору в соединениях всегда присваивается степень окисления -1.
- Щелочные металлы (группа I) всегда имеют степень окисления +1.
- Щелочноземельным металлам (группа II) всегда присваивается степень окисления +2.
- Кислород почти всегда имеет степень окисления -2, за исключением пероксидов (H 2 O 2 ), где она равна -1, и соединений с фтором (OF 2 ), где она равна +2.
- Водород имеет степень окисления +1 в сочетании с неметаллами, но он имеет степень окисления -1 в сочетании с металлами.
- Алгебраическая сумма степеней окисления элементов в соединении равна нулю.
- Алгебраическая сумма степеней окисления в ионе равна заряду иона.
Присвоение степеней окисления органическим соединениям
- Степень окисления любого химически связанного углерода может быть определена добавлением -1 для каждой связи к более электроположительному атому (H, Na, Ca, B) и +1 для каждой связи к более электроотрицательному атому (O, Cl, N, P) и 0 для каждого атома углерода, связанного непосредственно с интересующим углеродом.
 Например:
Например:
Именование Соединения
У каждого соединения есть имя. В идеале это название должно указывать на состав соединения и, возможно, кое-что о его свойствах. Такие названия называются систематические названия и основаны на наборе правил, составленных IUPAC. Несмотря на то что все соединения имеют систематические названия, многие также имеют тривиальные или общеупотребительные названия. В Таблице 6.1 перечислены общие (тривиальные) названия некоторых молекулярных соединений.Несколько ионных соединений перечислены в таблице. 6.2, как с их общими, так и с систематическими названиями.
ТАБЛИЦА 6.2 Названия и формулы некоторых распространенных ионных соединения. Общее название Систематическое название Формула отбеливатель гипохлорит натрия NaOCl мел карбонат кальция CaCO 3 известь оксид кальция СаО магнезиальное молоко гидроксид магния Мг(ОН) 2
А. Номера окисления
Номера окисления
Многие правила присвоения имен основаны на концепции степеней окисления. Степень окисления элемента представляет положительный или отрицательный характер (природу) атома этого элемента в конкретной ситуации связи. Номера окисления присваиваются по следующим правилам:- Степень окисления несвязанного элемента равна 0. В уравнении
Zn + 2 HCl H 2 + ZnCl 2
степень окисления цинка (Zn) в виде несвязанного атома равна 0, а степень окисления водорода в H 2 равна 0.
- Степень окисления одноатомного иона – это заряд этого иона. В ZnCl 2 , степень окисления хлора как Cl — равна -1, а цинка поскольку Zn 2+ равен +2. В Ag 2 S степень окисления серебра так как Ag + равен +1, а сера как S 2- равна -2.
- Водород в соединении обычно имеет степень окисления +1.
 Исключение
к этому правилу происходит, когда водород связан с металлом.
Исключение
к этому правилу происходит, когда водород связан с металлом. - Кислород в соединении обычно имеет степень окисления -2. Пероксиды исключение из этого правила: в перекиси водорода H 2 O 2 , например, степень окисления кислорода равна -1.
- Сумма степеней окисления атомов в соединении равна 0. Например, в соединении ZnCl 2 степень окисления иона цинка равна +2, а для каждого хлорид-иона -1. Сумма этих степеней окисления (+2 для цинка и -2 для двух ионов хлорида) равно 0.
- В многоатомном ионе суммарный заряд иона представляет собой сумму окисления
число атомов в ионе. Мы можем использовать это правило для расчета окисления
количество азота в нитрат-ионе, NO 3 — , по установке
составить следующее уравнение:
Степень окисления азота +3 (степень окисления кислорода) = -1 Степень окисления кислорода = -2 Подставляя, получаем: Степень окисления азот +3(-2) = -1 Переставляя это уравнение становится: Степень окисления азот = -1 — 3(-2) = -1 + 6 = + 5
Б.
 Бинарные соединения
Бинарные соединения
Многие химические соединения являются бинарными; то есть они содержат два элемента. Бинарный соединения бывают нескольких видов.1. Бинарные соединения, содержащие металл и неметалл
Бинарные соединения металла и неметалла содержат катион металла и неметаллический анион. Названия и формулы катионов и анионов были введены в разд. 5.7 (таблицы 5.7-5.9). Напомним, что щелочные металлы образуют только ионы с зарядом +1, щелочноземельные металлы образуют только ионы с зарядом +2, а алюминий образует только ион Al 3+ .Для этих ионов название элемента, за которым следует термин ион, является недвусмысленным. название. Например, ион натрия может быть только Na + , ион кальция только Ca 2+ . Согласно правилам IUPAC, названия всех других металлических катионы содержат название элемента, за которым следует его степень окисления (в скобки) в этом ионе. Это правило предотвращает двусмысленность. Название хром
ion не говорит, является ли ион Cr 2+ или Cr 3+ ;
собственные названия этих ионов — хром (II) и хром (III).Анионы
в бинарных соединениях называют корневым названием элемента, за которым следует
по суффиксу ide ; например, бром ид ион это Br — ,
ион сульф фиде представляет собой S 2-, а ион оксида представляет собой O 2-.
В этих примерах корневое имя элемента выделено курсивом. Для бинарных соединений
катион назван первым, а анион — вторым. Таким образом,
Название хром
ion не говорит, является ли ион Cr 2+ или Cr 3+ ;
собственные названия этих ионов — хром (II) и хром (III).Анионы
в бинарных соединениях называют корневым названием элемента, за которым следует
по суффиксу ide ; например, бром ид ион это Br — ,
ион сульф фиде представляет собой S 2-, а ион оксида представляет собой O 2-.
В этих примерах корневое имя элемента выделено курсивом. Для бинарных соединений
катион назван первым, а анион — вторым. Таким образом,NiCl 2 представляет собой хлорид никеля (II)
K 2 S – сульфид калия
CaBr 2 представляет собой бромид кальция
. ZnO – оксид цинка(II)
Прежде чем покинуть эту группу соединений, следует еще раз упомянуть о втором и менее предпочтительном способе обозначения катионов одного и того же элемента в разных степенях окисления. Этот старый метод дает окончание ous для иона с более низкой степенью окисления и окончание ic для иона с более высокой степенью окисления. Часто в этой системе также используется латинский корень названия элемента. Таким образом, в этой системе Fe 2+ является двухвалентным, а Fe 3+ трехвалентным; Pb 2+ — свинцовый, а Pb 4+ — свинцовый. Эти элементы, в которых используются латинские корни, показаны в таблице 6.3.
Этот старый метод дает окончание ous для иона с более низкой степенью окисления и окончание ic для иона с более высокой степенью окисления. Часто в этой системе также используется латинский корень названия элемента. Таким образом, в этой системе Fe 2+ является двухвалентным, а Fe 3+ трехвалентным; Pb 2+ — свинцовый, а Pb 4+ — свинцовый. Эти элементы, в которых используются латинские корни, показаны в таблице 6.3.ТАБЛИЦА 6.3 Некоторые элементы с неанглийскими корнями (корень выделен курсивом) Элемент Латинское название Элемент Латинское название медь чашка ром свинец слива бомж золото аур um серебро серебро тум железо ферр ум олово станн гм
2.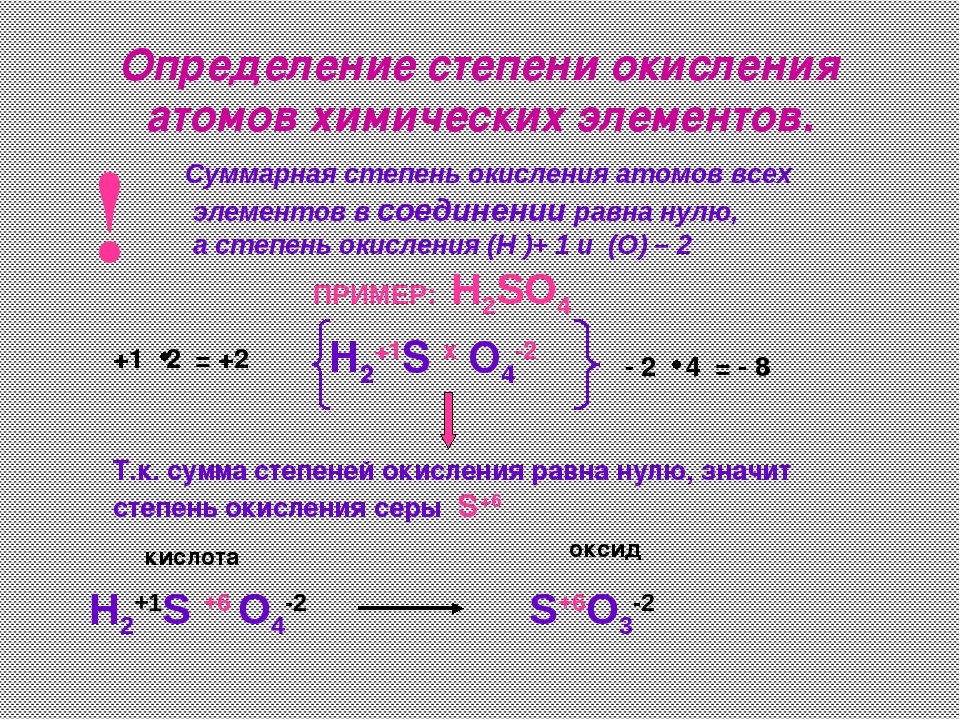 Бинарные соединения, содержащие два неметалла
но не водород
Бинарные соединения, содержащие два неметалла
но не водород
Бинарные соединения двух неметаллов, ни один из которых не является водородом, являются молекулярными а не ионный. Они не содержат катионов и анионов. Углекислый газ (CO 2 ) и трихлорид фосфора (PCl 3 ) являются примерами таких соединений. Они называются с использованием префиксов, чтобы указать, сколько атомов элемента находится в одном молекула соединения. (Префиксы перечислены в таблице 6.4.)ТАБЛИЦА 6.4 Префиксы, используемые в названиях бинарных соединений двух неметаллов Номер
атомовПрефикс Номер
атомовПрефикс Номер
атомовПрефикс 1 моно- 5 пента- 9 нон- 2 ди- 6 шестигранник 10 дека- 3 тройной 7 гепта- 11 хендека- 4 тетра- 8 окта- 12 додека- Имя второго элемента изменяется на корень его имени, за которым следует окончание ide.
 Как в формуле, так и в названии этих соединений первым идет самый неметаллический элемент (см. Рисунок 5.16 в главе 5). Префикс mono часто опускается для первого элемента, но никогда не опускается для второго. Таким образом,
Как в формуле, так и в названии этих соединений первым идет самый неметаллический элемент (см. Рисунок 5.16 в главе 5). Префикс mono часто опускается для первого элемента, но никогда не опускается для второго. Таким образом,
СО – окись углерода
SF 6 представляет собой гексафторид серы
. N 2 O – монооксид диазота3.Бинарные кислоты
Бинарное соединение, образующееся, когда галоген или любой элемент, кроме кислорода, из Соединения 6 группы периодической таблицы с водородом можно назвать так: бинарные неметаллические соединения, обсуждавшиеся в предыдущем разделе. Тем не мение, когда эти соединения растворяются в воде, раствор содержит водород ионы. Поскольку это свойство идентифицирует кислоту (раздел 5.7D), эти соединения также должны быть названы кислотами.Поэтому эти соединения имеют два набора названий, один для чистого состояния и один для соединения, растворенного в воде (см. Таблицу
6.5). Следует отметить два момента: (1) Название кислоты имеет префикс hydro .
и суффикс ic. (2) Эти формулы всегда записываются водородом
первый. Другие неметаллы образуют соединения с водородом, но они , а не .
кислоты; их формулы пишутся водородом в последнюю очередь. Метан, CH 4 ,
примерами являются аммиак, NH 3 , и арсин, AsH 3 .
Таблицу
6.5). Следует отметить два момента: (1) Название кислоты имеет префикс hydro .
и суффикс ic. (2) Эти формулы всегда записываются водородом
первый. Другие неметаллы образуют соединения с водородом, но они , а не .
кислоты; их формулы пишутся водородом в последнюю очередь. Метан, CH 4 ,
примерами являются аммиак, NH 3 , и арсин, AsH 3 .ТАБЛИЦА 6.5 Номенклатура бинарных кислот Формула Название в чистом виде Название в водном растворе HCl хлористый водород соляная кислота В 2 Ю сероводород сероводородная кислота HBr бромистый водород бромистоводородная кислота
4. Псевдобинарные соединения
Псевдобинарные соединения
Некоторые многоатомные ионы настолько похожи на одноатомные, что их классифицируют как как таковой. Эти ионы называются псевдобинарными ионами. В их состав входит аммоний ион, NH 4 + , гидроксид-ион, OH — , цианид ион, CN — и другие. Соединения, содержащие эти ионы, являются псевдобинарными. соединения.Свойства иона аммония очень похожи на свойства ионов щелочных металлов.Соединения, содержащие гидроксид-ион, являются основаниями. Общее определение основания состоит в том, что его водный раствор содержит больше гидроксида, чем ионов водорода. (Базы были введены в Раздел 5.7D.)
Ион цианида ведет себя очень похоже на ион галогена. Многие соединения, содержащие ион цианида, чрезвычайно токсичны.
C. Тройные соединения
Тройные соединения – это соединения, содержащие три элемента.Ионный тройной соединения образуются при соединении одноатомного катиона с многоатомным (содержащий несколько атомов) анион, как и в нитрате натрия, NaNO 3 . А
многоатомный анион является производным тройной кислоты.
А
многоатомный анион является производным тройной кислоты.1. Тройные кислоты и их анионы
Когда тройное соединение содержит водород и многоатомный анион (например, HNO 3 ), его название в чистом виде водород , за которым следует название аниона.Чистая HNO 3 имеет название нитрат водорода. Когда это соединение растворяется в воде, оно представляет собой кислоту и называется так. HNO 3 в водном растворе называется азотной кислотой. В таблице 6.6 приведены формулы некоторых из этих соединений, названия, которые они носят в водном растворе, степени окисления содержащихся в них неметаллов, кроме кислорода, а также названия и формулы их анионов. Правила обозначения этих соединений кислотами приведены в таблице. Обязательно изучайте таблицу, когда читаете правила и замечаете закономерности, показанные в именах и формулах.Правила наименования тройных кислот следующие:
- Название наиболее распространенной оксикислоты для конкретного
неметалл — это корень названия элемента плюс суффикс ic .
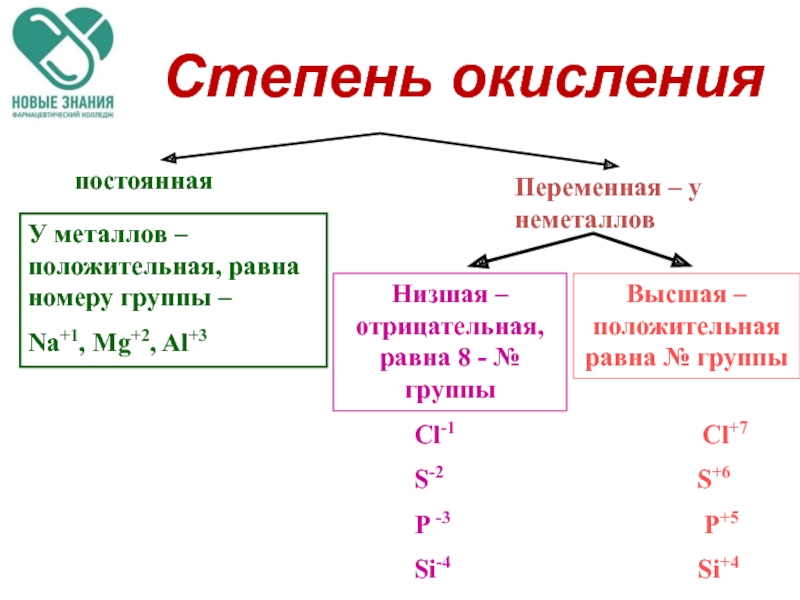 Она имеет
без префикса. Название аниона этой кислоты является корнем элемента
имя плюс суффикс ели . Степень окисления неметалла в этом
кислотность высокая, но не обязательно максимально возможная.Эти кислоты иногда
упоминается как ic-ate кислот. Из оксикислот в таблице 7.6 азотная,
серная, фосфорная и хлорная относятся к разряду «наиболее распространенных». В
в таблице, в формулах, отмеченных звездочкой, указаны наиболее распространенные кислоты
для конкретного неметалла.
Она имеет
без префикса. Название аниона этой кислоты является корнем элемента
имя плюс суффикс ели . Степень окисления неметалла в этом
кислотность высокая, но не обязательно максимально возможная.Эти кислоты иногда
упоминается как ic-ate кислот. Из оксикислот в таблице 7.6 азотная,
серная, фосфорная и хлорная относятся к разряду «наиболее распространенных». В
в таблице, в формулах, отмеченных звездочкой, указаны наиболее распространенные кислоты
для конкретного неметалла. - Название кислоты, в которой неметалл имеет
следующая более низкая степень окисления — это корень элемента плюс суффикс ous. Название его аниона — корень плюс ите .Эти кислоты можно назвать ус-ит кислоты. Из кислот в таблице 6.6 азотистая, сернистая и хлористая
попасть в эту группу. Их формулы можно предсказать, если вы узнали
формулы первой группы. Анион кислоты ус-ит содержит
на один атом кислорода меньше, чем у кислоты ic-ate .
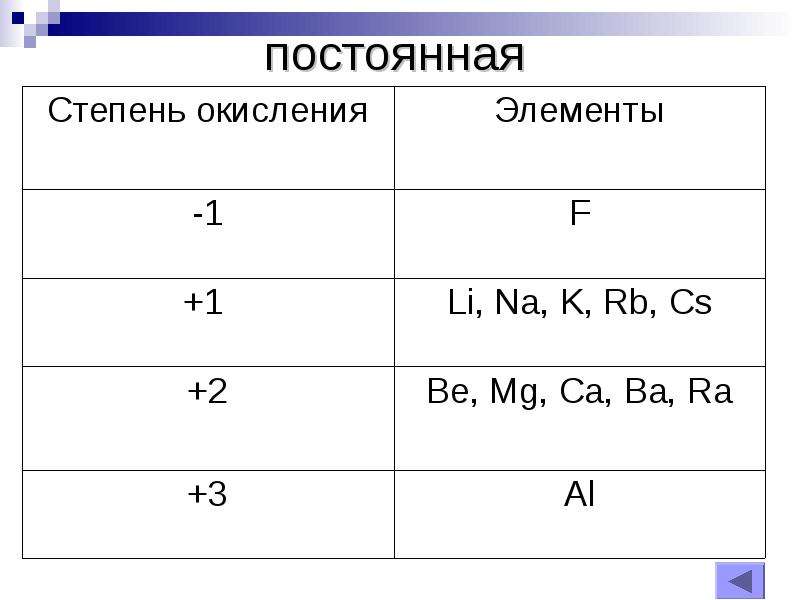
- Как и в случае с галогенами, если имеется оксикислота, в которой неметалл имеет еще более низкую степень окисления, эта кислота названа с использованием префикс-суффикс гипо-оус, и его анион с использованием гипо-ит. Из из кислот, указанных в таблице 6.6, в эту категорию входит только хлорноватистая кислота. Его формула можно предсказать, если знать формулу хлорной кислоты. Анионы этих кислоты содержат на два атома кислорода меньше, чем анионы ic-ate кислоты.
- Опять же, как с галогенами, если есть оксикислота
в которых неметалл имеет более высокую степень окисления, чем в наиболее распространенных
кислота, эта кислота называется per-ic кислота и ее анион per-ate. Из кислот, указанных в таблице 6.6, в эту группу входит только хлорная. Его формула может
можно предсказать по формуле хлорной кислоты. Анион будет содержать один
больше атома кислорода, чем анион кислоты ic-ate .

Формулы солей этих кислот представляют собой нейтральные комбинации ионов (обсуждается в Раздел 6.1). Чтобы назвать их, сначала назовите катион в соответствии с правилами, приведенными в Раздел 6.2Б1. Названия анионов приведены в таблице 6.6.
2. Тройные кислоты, содержащие углерод
Многие кислоты содержат только углерод, водород и кислород. Например, уксусная кислота. Его формула может быть записана какHC 2 H 3 O 2 или HCH 3 CO 2 или CH 3 COOH или CH 3 CO 2 H
Независимо от того, как это написано, есть только один кислотный водород в уксусной кислоте; остальные три атома водорода не разделяются в виде ионов водорода в водный раствор.Обратите внимание, как кислый водород помещается сам по себе в каждую формул для обозначения этой разницы.
 Многие кислоты, такие как уксусная кислота, содержат
группа атомов, связанных с группой -COOH. Только водород группы -COOH
представляет собой кислотный водород. Например,
Многие кислоты, такие как уксусная кислота, содержат
группа атомов, связанных с группой -COOH. Только водород группы -COOH
представляет собой кислотный водород. Например,C 6 H 5 COOH бензойная кислота
C 2 H 3 СООН акриловая кислота
Эти кислоты называются карбоновыми кислотами.Более полно они обсуждаются в Глава 15. В названии анионов этих кислот ic кислоты заменены на a te. Таким образом,
уксусная кислота HC 2 H 3 O 2 , дает ацетат-ион, C 2 H 3 O 2 — бензойная кислота C 6 H 5 COOH, дает бензоат-ион, C 2 H 5 COO — акриловая кислота C 2 H 3 COOH, дает акрилат-ион, C 2 H 3 COO —
3. Соли, содержащие более одного катиона
Соли, содержащие более одного катиона
Иногда вы встретите соль, содержащую более одного катиона. Если оба катиона являются металлами, их называют в том порядке, в котором они записаны по уже приведенным правилам. Если один из катионов является водородом, соль можно назвать, либо назвав катион водородом , либо добавив bi в качестве префикса к названию аниона. Таким образом, NaHCO 3 можно назвать гидрокарбонатом натрия или бикарбонатом натрия.Соли с более чем одним катионом, одним из которых является водород, иногда называют кислыми солями.Степень окисления — Стехиометрия — Содержание MCAT
степень окисления – это эффективный заряд атома в соединении; степень окисления полезна при определении номенклатуры или названия химических соединений.
Степень окисления явно описывает степень, в которой элемент может быть окислен (терять электроны) или восстановлен (приобретать электроны).
 Существует фиксированный набор правил, которым можно следовать для определения степени окисления. Степень окисления обычно можно найти над группами в периодической таблице.
Существует фиксированный набор правил, которым можно следовать для определения степени окисления. Степень окисления обычно можно найти над группами в периодической таблице.1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы только одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 и металлическом алюминии имеют степень окисления 0,
.2. Степень окисления простых ионов равна заряду иона.Например, степень окисления натрия в ионе Na + равна +1, а степень окисления хлора в ионе Cl – равна -1.
3. Степень окисления водорода равна +1, когда он сочетается с неметаллом , как в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он сочетается с металлом , например, в LiH, NaH, CaH 2 и LiAlH 4 .
5.Металлы группы IA образуют соединения (такие как Li 3 N и Na 2 S), в которых атом металла имеет степень окисления +1.

6. Элементы группы IIA образуют соединения (такие как Mg 3 N 2 и CaCO 3 ), в которых атом металла имеет степень окисления +2.
7. Кислород обычно имеет степень окисления -2. Исключения составляют молекулы и многоатомные ионы, содержащие связи O-O, такие как O 2 , O 3 , H 2 O 2 и ион O 2 2- .
8. Элементы группы VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ), в которых неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
Окислительно-восстановительные реакции происходят, когда один элемент окисляется, а другой восстанавливается в одной и той же реакции. Например, реакция между цинком и серой, в результате которой образуется сульфид цинка:
Полуреакции можно записать:
В приведенной выше реакции цинк окисляется, теряя электроны.
 Однако должно присутствовать другое вещество, которое получает эти электроны, и в данном случае это сера. Другими словами, сера вызывает окисление цинка. Серу называют окислителем. Цинк заставляет серу приобретать электроны и восстанавливаться, поэтому цинк называют восстановителем. Окислитель представляет собой вещество, которое вызывает окисление, принимая электроны. Восстановитель представляет собой вещество, вызывающее восстановление за счет потери электронов.Простейший способ представить это так: окислитель — это вещество, которое восстанавливается, а восстановитель — это вещество, которое окисляется. Пример задачи ниже показывает, как анализировать окислительно-восстановительную реакцию.
Однако должно присутствовать другое вещество, которое получает эти электроны, и в данном случае это сера. Другими словами, сера вызывает окисление цинка. Серу называют окислителем. Цинк заставляет серу приобретать электроны и восстанавливаться, поэтому цинк называют восстановителем. Окислитель представляет собой вещество, которое вызывает окисление, принимая электроны. Восстановитель представляет собой вещество, вызывающее восстановление за счет потери электронов.Простейший способ представить это так: окислитель — это вещество, которое восстанавливается, а восстановитель — это вещество, которое окисляется. Пример задачи ниже показывает, как анализировать окислительно-восстановительную реакцию.Другой тип реакции, в которой можно наблюдать окислительно-восстановительный потенциал, – это реакция диспропорционирования , , в которой соединение со средней степенью окисления превращается в два соединения, одно с более высокой, а другое с более низкой степенью окисления.
 В примере разложения перекиси водорода кислород присутствует в реагенте и в обоих продуктах . В H 2 O 2 кислород имеет степень окисления -1. В H 2 O его степень окисления равна -2, и он был восстановлен. Однако в O 2 его степень окисления равна 0, и он был окислен. Кислород в ходе реакции как окисляется, так и восстанавливается.
В примере разложения перекиси водорода кислород присутствует в реагенте и в обоих продуктах . В H 2 O 2 кислород имеет степень окисления -1. В H 2 O его степень окисления равна -2, и он был восстановлен. Однако в O 2 его степень окисления равна 0, и он был окислен. Кислород в ходе реакции как окисляется, так и восстанавливается.2 H 2 O 2 (водн.) → 2 H 2 O(л) + O 2 (г)
Практические вопросыАкадемия Хана
Применение теории жесткого и мягкого кислотно-основного состояния
Официальная подготовка MCAT (AAMC)Пакет вопросов по химии Вопрос 55
Пакет вопросов по химии, отрывок 16, вопрос 89
Пакет вопросов по химии, отрывок 19, вопрос 107
Пакет вопросов по химии, отрывок 20, вопрос 115
Образец теста C/P Раздел 5 Вопрос 22
Практический экзамен 2 C/P Раздел 5 Вопрос 24
Практический экзамен 4 C/P Section Pass 1 Question 3
Ключевые моменты• Степень окисления говорит о том, сколько электронов элемент может отдать или получить
• Степень окисления чистого элемента всегда равна нулю.

• Степень окисления чистого иона эквивалентна его ионному заряду.
• Обычно водород имеет степень окисления +1, а кислород имеет степень окисления -2.
• Сумма степеней окисления всех атомов нейтральной молекулы должна быть равна нулю.
• Восстановление – это присоединение электронов, вызывающее уменьшение степени окисления
• Окисление – это потеря электронов, что вызывает увеличение степени окисления
• В непропорциональных реакциях химические соединения восстанавливаются и окисляются одновременно
Основные терминыОкисление: потеря электронов в веществе (Cu в Cu +2 )
Восстановление: прирост электронов в веществе (Cu +2 до Cu)
Реакция диспропорционирования: реакция, при которой соединение с промежуточной степенью окисления превращается в два соединения, одно с более высокой, а другое с более низкой степенью окисления, чем промежуточная степень окисления
Окислитель: вещество, вызывающее окисление путем принятия электронов
Восстановитель: вещество, вызывающее восстановление за счет потери электронов
Степень окисления: эффективный заряд атома в соединении
.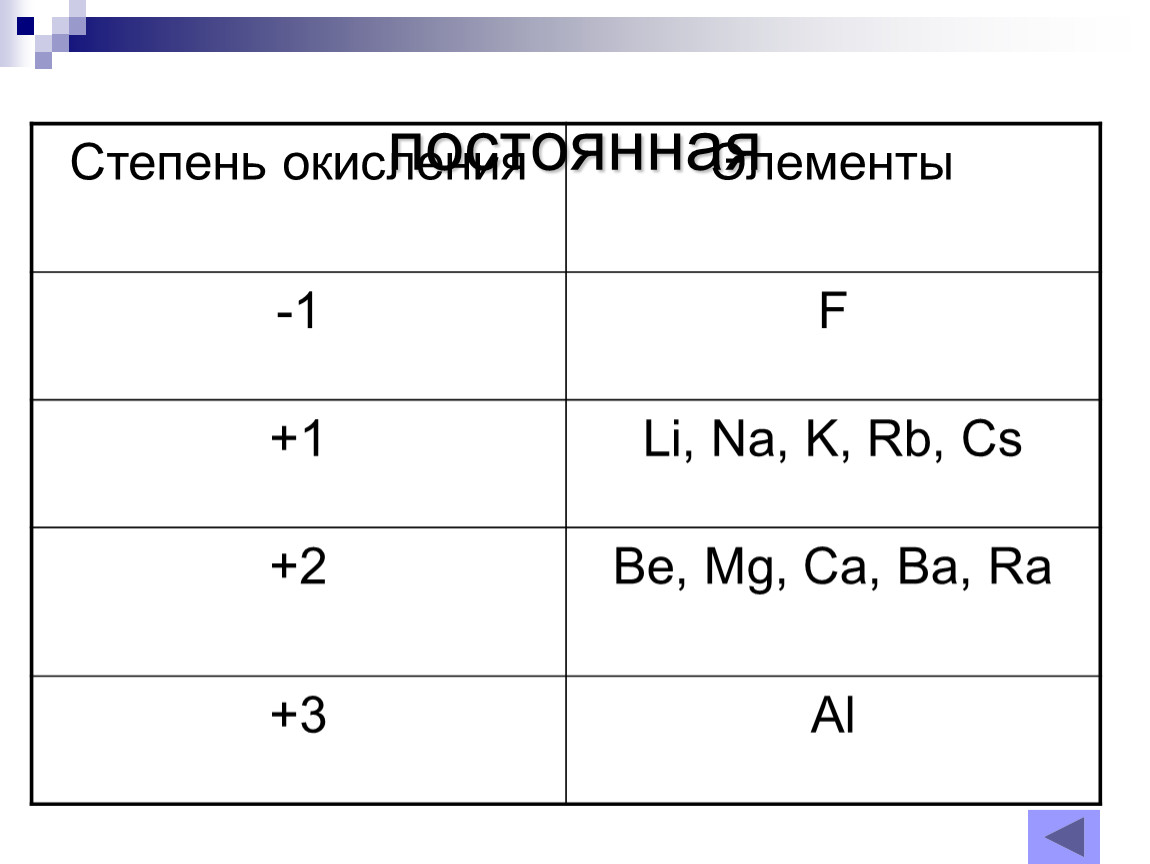
- Степень окисления свободного элемента всегда равна 0.






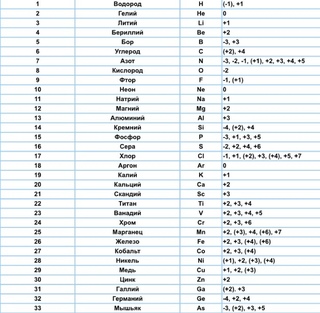 Степени окисления химических элементов по номеру.
Степени окисления химических элементов по номеру.


 Однако существует немало
случаев, когда валентность отличается от степени окисления.
Однако существует немало
случаев, когда валентность отличается от степени окисления. Атомы
d
-элементов
могут также отдавать электроны с передзовнішнього уровня, а именно — с
незаполненных
d
-орбиталей. Поэтому
для
d
-элементов определить все возможные
степени окисления значительно сложнее, чем для
s
—
и р-элементов. С уверенностью можно
утверждать, что большинство
d
-элементов
проявляют степень окисления +2 благодаря электронам внешнего электронного
уровня, а максимальная степень окисления в большинстве случаев равен номеру
группы.
Атомы
d
-элементов
могут также отдавать электроны с передзовнішнього уровня, а именно — с
незаполненных
d
-орбиталей. Поэтому
для
d
-элементов определить все возможные
степени окисления значительно сложнее, чем для
s
—
и р-элементов. С уверенностью можно
утверждать, что большинство
d
-элементов
проявляют степень окисления +2 благодаря электронам внешнего электронного
уровня, а максимальная степень окисления в большинстве случаев равен номеру
группы. д.
д. Определим степень окисления в сульфур(И
V
) оксиде
SO
2
тауфосфор(V
)
сульфіді
P
2
S
5
.
Определим степень окисления в сульфур(И
V
) оксиде
SO
2
тауфосфор(V
)
сульфіді
P
2
S
5
.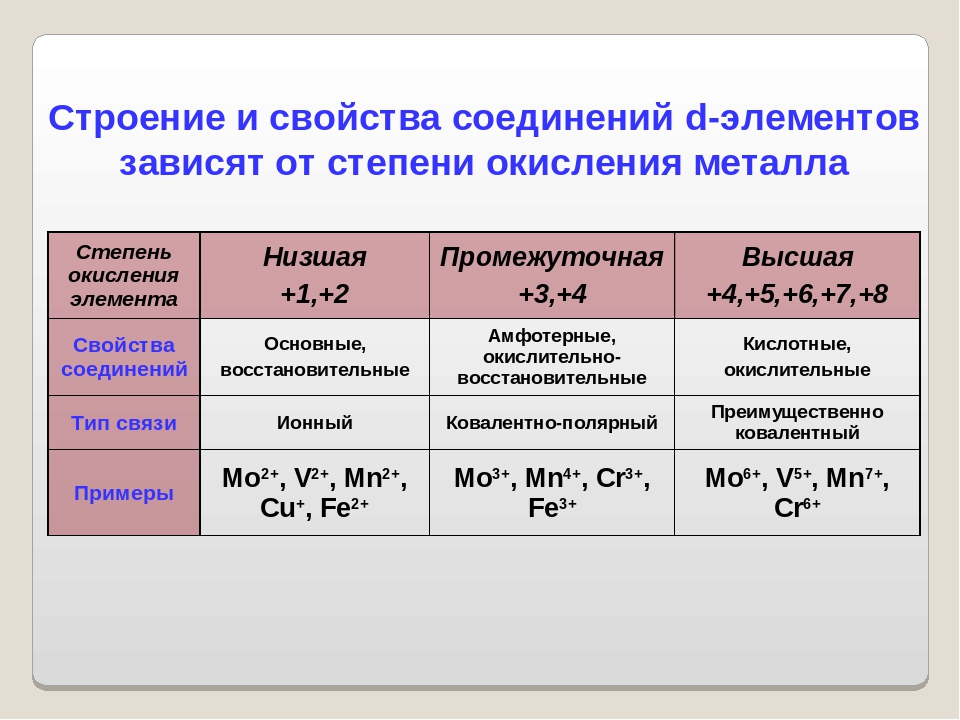 Вместе пять
атомов Серы несут отрицательный заряд, равный-10. Поэтому два атома
Фосфора имеют нейтрализовать этот заряд с общим зарядом +10. Поскольку атомов
Фосфора в молекуле два, то каждый должен иметь степень окисления +5:
Вместе пять
атомов Серы несут отрицательный заряд, равный-10. Поэтому два атома
Фосфора имеют нейтрализовать этот заряд с общим зарядом +10. Поскольку атомов
Фосфора в молекуле два, то каждый должен иметь степень окисления +5:
 Высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключение составляют: Au +3 (I группа), Cu +2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru .
Высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключение составляют: Au +3 (I группа), Cu +2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru .



