Как определить степень окисления? — материалы для подготовки к ЕГЭ по Химии
Автор — Александр Игоревич Новичков .
Степень окисления — это формальный заряд атома. Слово «формальный» означает, что этого заряда у атома в действительности может и не быть, вернее, он может оказаться немного другим. Однако по разным причинам эти условные заряды удобны и химики всего мира пользуются понятием «степень окисления».
Отметим, что степень окисления указывается в верхнем правом углу атома в формате или , где – целое число. Например:
Существуют определённые правила нахождения степени окисления.
- Степень окисления простых веществ равна нулю. Напомню, что простыми называют вещества, состоящие из одного вида атомов. Примеры:
- Некоторые атомы в сложных соединениях проявляют только одну степень окисления. Такие степени окисления называются постоянными.
— Исключения у водорода соединения , в которых у водорода степень окисления
— Исключения у кислорода
- Сумма степеней окисления всех атомов сложного соединения должна быть равна нулю.
 Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Как именно?
- Сумма степеней окисления всех атомов сложного соединения должна быть равна нулю.
Пример 1: расставьте степени окисления в соединении .
Мы знаем степень окисления тогда мы можем найти, что общее количество «плюсов» у четырех атомов . Чтобы в сумме был ноль, у трех атомов заряд должен быть , значит у каждого атома
Пример 2: Найдите степени окисления всех атомов в соединении
Сначала подпишем постоянные степени окисления
Посчитаем общее количество плюсов и минусов
Для того, чтобы плюсов и минусов было одинаковое количество у двух хромов в сумме должно быть , а значит, у каждого атома
Пример 3: Найдите степени окисления всех атомов в соединении
Для начала заметим, что для нахождения степени окисления удобно «раскрыть скобки» и представить соединение как и тогда задание выполняется аналогично заданию из примера 2.
- В некоторых устоявшихся группах атомов в составе веществ (кислотные остатки и ион аммония) степени окисления атомов неизменны и их тоже стоит запомнить.

- В некоторых устоявшихся группах атомов в составе веществ (кислотные остатки и ион аммония) степени окисления атомов неизменны и их тоже стоит запомнить.
Пользуясь этими правилами, можно расставить степени окисления практически во всех соединений, встречающихся на ЕГЭ по химии.
Если вам понравился наш материал — записывайтесь на курсы подготовки к ЕГЭ по химии онлайн
Спасибо за то, что пользуйтесь нашими материалами. Информация на странице «Как определить степень окисления?» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ. Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий. Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена: 06.02.2023
Валентность. Степень окисления химических элементов
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).
- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.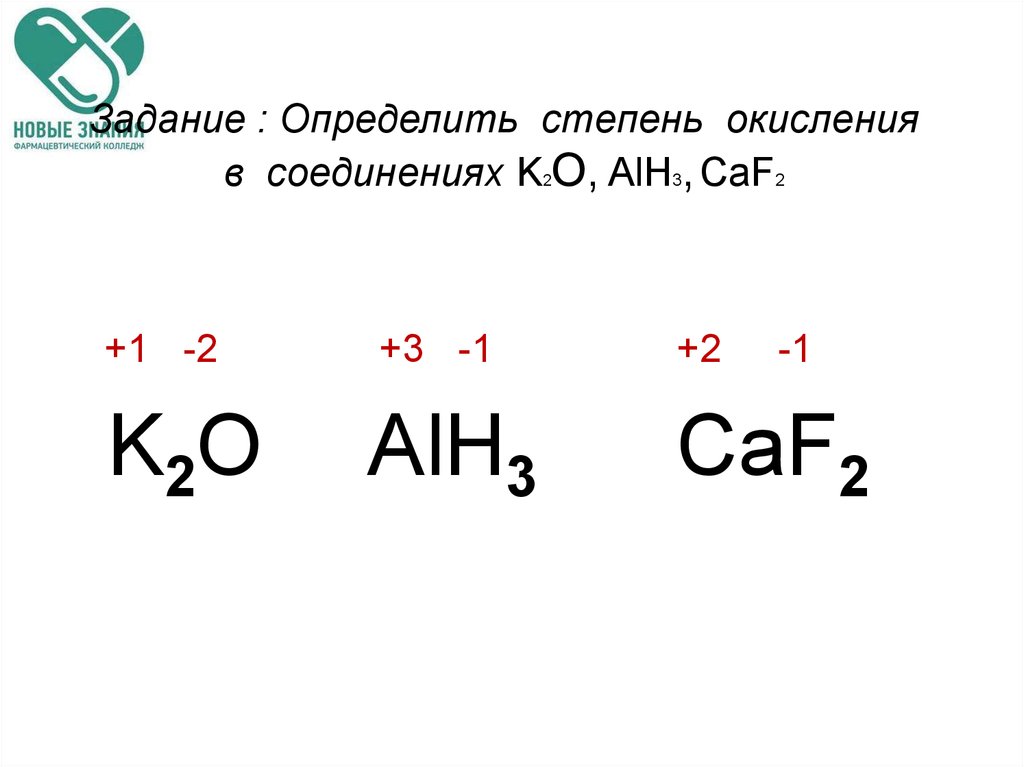
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2.
- h3 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)h5(-), B2(+3)H6(-), B(+3)h4(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)h3(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например h3(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).

- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.
- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
Пример
Фосфор (P)
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0.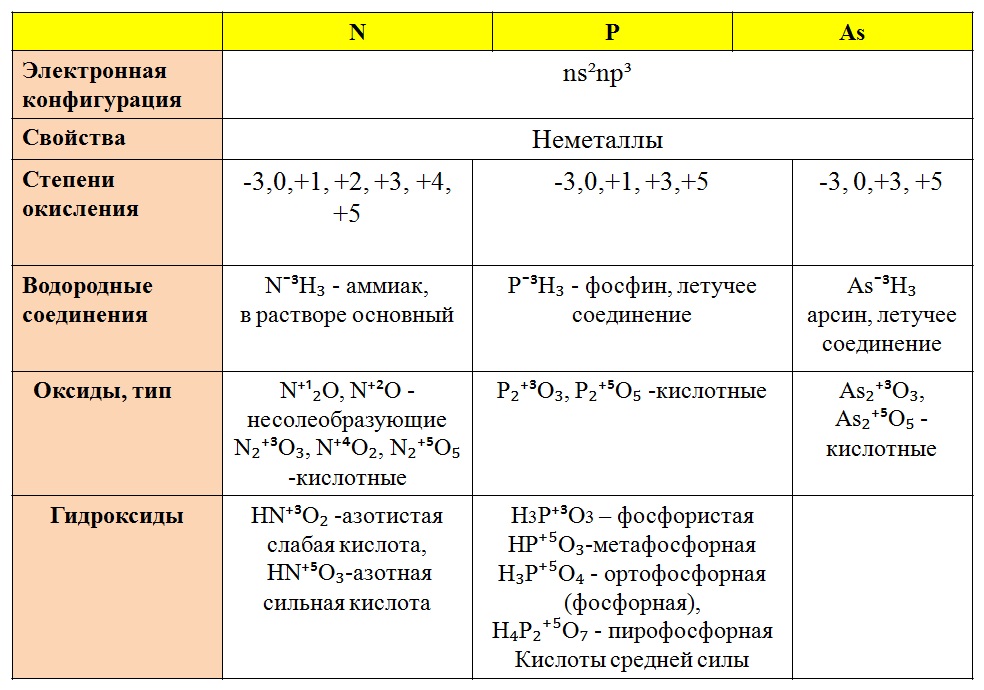 Отсюда х = +6.
Отсюда х = +6.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
Как найти число и степень окисления
Учебные пособия
- Сообщение от химический разговор
16
июняЧисло окисления и степень окисления — два очень важных понятия в химии. В этой статье мы сделаем их очень простыми для понимания!
Охвачено в других статьях:
Катионы и ионы
Окислительно-восстановительные реакции
Общие многоатомные ионы
Электрохимические ячейки
Что такое ионы?
Степень окисления – определение
Степень окисления показывает, сколько электронов приобрел или потерял атом в молекуле. Элементы имеют нулевую степень окисления, а атомам в ионных соединениях обычно приписывают положительную или отрицательную степень окисления. Органические соединения и некоторые ковалентные соединения не имеют степеней окисления, присвоенных атомам в соединениях.
Элементы имеют нулевую степень окисления, а атомам в ионных соединениях обычно приписывают положительную или отрицательную степень окисления. Органические соединения и некоторые ковалентные соединения не имеют степеней окисления, присвоенных атомам в соединениях.
Иными словами, степень окисления атома равна количеству электронов, которые были удалены из элемента (что приводит к положительной степени окисления) или добавлены к элементу (что приводит к отрицательной степени окисления).
Если вы хотите использовать определение ИЮПАК, вот оно: » Степень окисления атома – это заряд этого атома после ионной аппроксимации его гетероядерных связей »
Степень окисления – Определение
Степень окисления атома атом — это просто его степень окисления. разницы нет * .
(*Читайте последний раздел статьи, чтобы узнать об исключении)
Как найти степень окисления
Используя несколько простых правил, вы можете легко определить степень окисления каждого атома в молекуле.
Правила номеров окисления
Используйте эти правила для определения степени окисления каждого атома в соединении.
- Фтор всегда -1.
- Кислород всегда равен -2, за исключением случаев, когда он находится с фтором или когда он находится в пероксиде или пероксианионе, таком как пероксидный ион, и в этом случае он равен -1.
- Степень окисления атома в его элементарном состоянии равна нулю. Например, He, O 2 , S 8
- В ионном соединении с двумя элементами металл или более электроотрицательный атом имеет положительную степень окисления, а неметалл или менее электроотрицательный атом имеет отрицательную степень окисления.
- Щелочные металлы (металлы группы 1), такие как натрий и калий, имеют степень окисления +1
- Щелочноземельные металлы (металлы группы 2), такие как кальций и магний, +2
- Водород равен +1 в сочетании с неметаллом, например, хлористым водородом HCL. Это -1 в сочетании с металлом, например гидридом натрия, NaH.

- Галогены имеют степень окисления -1 в сочетании с одним другим элементом (бинарные соединения), за исключением межгалогеновых соединений. Например, фторид натрия NaF, йодид кальция CaI 2 , хлорид хрома (III) CrCl 3 , бромид олова (II) SnBr 2 . В каждом случае галоген имеет степень окисления -1.
- Заряд одноатомного иона (иона, состоящего из атомов 1 типа) может сказать вам о степени окисления. Например, степень окисления меди в соединении меди (II) равна +2. Ртуть в ионе ртути (Hg 2 +2 ) равна +1 (в этом случае нужно разделить заряд на 2). Азот -3 в нитрид-ионе, N -3
- В многоатомном ионе сумма степеней окисления отдельных атомов должна равняться заряду иона. Если кислород присутствует, предположим, что кислород равен -2. Мы создали видео, чтобы объяснить, как это делается.
Примеры степени окисления по правилу 10:
Например, в нитрат-ионе NO 3 – заряд иона равен -1. Используя правило 2, мы знаем, что заряд кислорода равен 3 x-2 = -6. Таким образом, азот должен иметь заряд +5, чтобы сделать заряд иона -1.
Используя правило 2, мы знаем, что заряд кислорода равен 3 x-2 = -6. Таким образом, азот должен иметь заряд +5, чтобы сделать заряд иона -1.Ион хлорита, ClO2-, имеет заряд -1. Используя правило 2, мы знаем, что заряд кислорода равен 2 x -2 = -4. Таким образом, хлор должен иметь заряд +3, чтобы сделать заряд иона хлорита -1.
Элементы с наибольшим количеством степеней окисления
Ванадий, марганец и хром имеют наибольшее разнообразие стабильных степеней окисления и цветов. На обложке этой статьи, сделанной Уилко Оэленом (который был одним из многих вдохновителей ChemTalk), показаны цвета соединений ванадия в степенях окисления +2, +3, +4 и +5.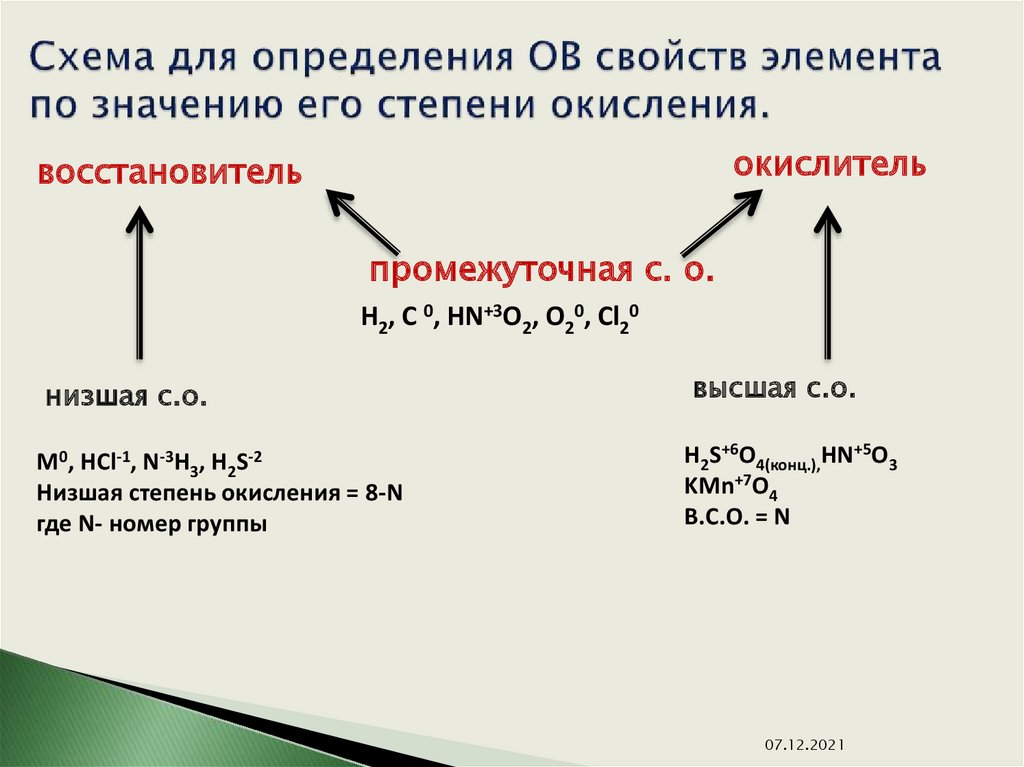 Вольфрам и молибден также имеют несколько степеней окисления, некоторые из которых менее изучены, чем другие переходные металлы.
Вольфрам и молибден также имеют несколько степеней окисления, некоторые из которых менее изучены, чем другие переходные металлы.
Забавный факт . Сообщается, что самая высокая известная степень окисления равна +9 в катионе тетраксоиридия (IX) (IrO 4 + ).
Какова степень окисления и количество серы в ионе тетратионата?
В тетратионат-ионе S 4 O 6 -2 две серы имеют степень окисления 0, а две имеют степень окисления +5. «Средняя» степень окисления серы в молекуле равна (0+0+5+5)/4 = 2,5. Только в этих соединениях со смешанными степенями окисления может возникнуть понятие степени окисления, отличной от степени окисления 9.0003
Как узнать номер окисления?
Чтобы узнать, как найти степень окисления атома в данном соединении, важно узнать, что такое степени окисления. Степень окисления атома — это число, которое представляет собой общее число потерянных или приобретенных им электронов или .
Содержание
- Расчет степени окисления
- решенных примеров
- Соляная кислота (HCl)
- Двуокись углерода (CO2)
- Часто задаваемые вопросы – Часто задаваемые вопросы
Расчет степени окисления
Степень окисления может быть присвоена данному элементу или соединению, следуя следующим правилам.
- Любой свободный элемент имеет степень окисления, равную нулю.
- Для одноатомных ионов степень окисления всегда равна суммарному заряду, соответствующему иону.
- Атом водорода (H) проявляет степень окисления +1. Однако при соединении с элементом с меньшей электроотрицательностью, чем у него, он проявляет степень окисления -1.
- Кислород имеет степень окисления -2 в большинстве своих соединений. Однако в случае пероксидов степень окисления, соответствующая кислороду, равна -1.
- Все щелочные металлы (элементы группы 1) в своих соединениях имеют степень окисления +1.

- Все щелочноземельные металлы (элементы группы 2) проявляют в своих соединениях степень окисления +2.
- В соединениях, состоящих из двух элементов, галоген (элементы группы 17) имеет присвоенную им степень окисления -1.
- В случае нейтральных соединений сумма всех степеней окисления составляющих их атомов равна нулю.
- Когда рассматриваются многоатомные ионы, сумма всех степеней окисления составляющих их атомов равна суммарному заряду многоатомного иона.
Таким образом, степень окисления атома в данном соединении может быть рассчитана с помощью шагов, упомянутых выше.
Решенные примеры
Чтобы помочь учащимся понять, как найти степень окисления, ниже определены степени окисления каждого отдельного атома в некоторых примерах соединений.
Выше приведена иллюстрация, объясняющая, как найти степень окисления атома серы в молекуле сульфата натрия.
Соляная кислота (HCl)
- В соответствии с правилами, рассмотренными выше, степень окисления элемента 17 группы (галогена) в двухатомной молекуле равна -1.
 Также обсуждается, что водород всегда имеет степень окисления +1, если только он не соединен с менее электроотрицательным элементом.
Также обсуждается, что водород всегда имеет степень окисления +1, если только он не соединен с менее электроотрицательным элементом. - Поскольку хлор более электроотрицателен, чем водород, атому водорода в HCl можно присвоить степень окисления +1.
- Следовательно, степень окисления водорода равна +1, а степень окисления хлора равна -1 в HCl. Эти значения можно проверить, добавив эти степени окисления. Поскольку общее количество равно нулю, что является значением степени окисления, соответствующей нейтральной молекуле, значения проверяются.
Углекислый газ (СО
2 )- Согласно правилам расчета степени окисления, которые можно найти в предыдущем подразделе, степень окисления кислорода в его соединениях (исключая пероксиды) равна -2.
- Поскольку в диоксиде углерода два атома кислорода, сумма степеней окисления, соответствующих каждому кислороду, равна -4.
- Поскольку молекула CO 2 нейтральна, атом углерода должен иметь степень окисления +4 (сумма всех степеней окисления в нейтральной молекуле равна нулю).

- Таким образом, степень окисления кислорода оказалась равной -2, а степень окисления углерода равна +4 в молекуле углекислого газа.
Учащиеся могут понять, как найти степень окисления с помощью решенных примеров, приведенных выше. Чтобы узнать больше о степенях окисления и других связанных понятиях, таких как окислители, зарегистрируйтесь в BYJU’S и загрузите мобильное приложение на свой смартфон.
Часто задаваемые вопросы – Часто задаваемые вопросы
В чем разница между степенью окисления и степенью окисления?
Степень окисления отличается от степени окисления тем, что степень окисления описывает степень окисления атома в молекуле, тогда как степень окисления описывает заряд, который атом основного металла сохранит после удаления всех лигандов.
Степень окисления остается прежней?
Большинство степеней окисления остаются неизменными, и меняются только степени окисления для соединений, которые окисляются или восстанавливаются.


 Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.


 Используя правило 2, мы знаем, что заряд кислорода равен 3 x-2 = -6. Таким образом, азот должен иметь заряд +5, чтобы сделать заряд иона -1.
Используя правило 2, мы знаем, что заряд кислорода равен 3 x-2 = -6. Таким образом, азот должен иметь заряд +5, чтобы сделать заряд иона -1.
 Также обсуждается, что водород всегда имеет степень окисления +1, если только он не соединен с менее электроотрицательным элементом.
Также обсуждается, что водород всегда имеет степень окисления +1, если только он не соединен с менее электроотрицательным элементом.